当前位置:
试题详情
下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH⇌CH3COO-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3⇌H++HCO3- | K1=4.4×10-7 |
| HCO3-⇌H++CO32- | K2=4.7×10-11 | |
| H2S | H2S⇌H++HS- | K1=1.3×10-7 |
| HS-⇌H++S2- | K2=7.1×10-15 |
CH3COOH
CH3COOH
,最弱的是 HS-
HS-
。(2)物质的量浓度为0.1mol/L的下列四种物质:
a.Na2CO3
b.Na2S
c.NaHCO3
d.CH3COONa
pH由大到小的顺序是
b>a>c>d
b>a>c>d
。(3)分析多元弱酸各步电离的K值大小,你认为一定浓度的某多元弱酸溶液中,c(H+)的大小主要由第一步电离程度大小决定。假设某氢硫酸溶液的浓度为0.0013mol•L-1,则溶液中c(H+)=
1.3×10-5mol•L-1
1.3×10-5mol•L-1
。(4)请设计一种方案,能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用试剂是
醋酸、Na2S溶液
醋酸、Na2S溶液
,反应的化学方程式为 Na2S+2CH3COOH═H2S↑+2CH3COONa
Na2S+2CH3COOH═H2S↑+2CH3COONa
。(5)在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题。
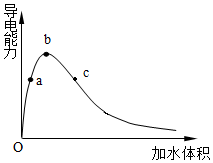
①“O”点时液体不能导电,说明醋酸中
不含
不含
离子键(填“含有”或“不含”)。②a、b、c三点醋酸电离程度由大到小的顺序为
c>b>a
c>b>a
;a、b、c三点对应的溶液中c(H+)最大的是 b
b
。③常温下,取pH=2的盐酸和醋酸各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸pH变化曲线的是
B
B
(填“A”或“B”)。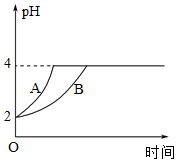
【考点】弱电解质的电离平衡.
【答案】CH3COOH;HS-;b>a>c>d;1.3×10-5mol•L-1;醋酸、Na2S溶液;Na2S+2CH3COOH═H2S↑+2CH3COONa;不含;c>b>a;b;B
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/27 10:35:59组卷:10引用:1难度:0.6


