已知某大理石中含有少量的二氧化硅和氧化铁杂质。如图是该大理石制备高纯碳酸钙的主要流程:
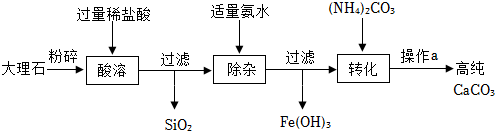
已知:Ⅰ.(NH4)2CO3 加热 2NH3↑+H2O+CO2↑
Ⅱ.氨水(NH3⋅H2O)溶液中能解离出NH+4和OH-
(1)“酸溶”时,与稀盐酸发生反应的物质是 CaCO3和Fe2O3CaCO3和Fe2O3(用化学式表示)。
(2)过滤用到的玻璃仪器有 玻璃棒玻璃棒、烧杯、漏斗。过滤后发现滤液仍然浑浊,可能的原因有 acac(填字母)。
a.滤纸破损
b.滤纸未贴紧漏斗内壁
c.漏斗内的液面高于滤纸边缘
(3)“除杂”时,随着反应的进行,溶液的pH逐渐 增大增大(选填“增大”“减小”或“不变”);写出“除杂”过程中生成Fe(OH)3的化学方程式为 FeCl3+3NH3•H2O=Fe(OH)3↓+3NH4ClFeCl3+3NH3•H2O=Fe(OH)3↓+3NH4Cl。
(4)“转化”时,发生的主要反应的化学方程式是 CaCl2+(NH4)2CO3=CaCO3↓+2NH4ClCaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl。该步骤在较低温度下进行的原因是 防止(NH4)2CO3受热分解防止(NH4)2CO3受热分解。
(5)“操作a”的具体操作是:过滤、洗涤、干燥。若缺少洗涤操作,产品中可能会混有 氯化钙、碳酸铵氯化钙、碳酸铵杂质(写出一种即可)。
加热
NH
+
4
【答案】CaCO3和Fe2O3;玻璃棒;ac;增大;FeCl3+3NH3•H2O=Fe(OH)3↓+3NH4Cl;CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl;防止(NH4)2CO3受热分解;氯化钙、碳酸铵
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/11 8:0:9组卷:39引用:4难度:0.5
相似题
-
1.新冠肺炎疫情防控期间,西安市各学校开展全域喷洒低浓度、有效成分是次氯酸钠的“84”消毒液进行消毒。如图所示是模拟制备“84”消毒液的流程(Cl2是一种黄绿色的有毒气体)。请回答下列问题:
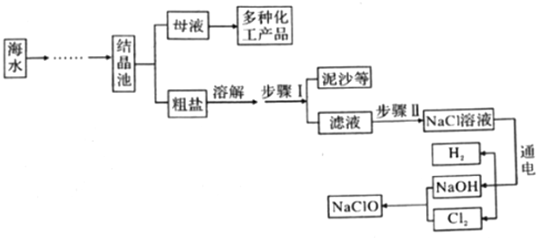
(1)NaOH的俗称为(写一种)。
(2)步骤Ⅱ中,通常用碳酸钠溶液除去滤液中的氯化钙杂质,请写出有关反应的化学方程式。
(3)电解水时,一般在水中加入少量NaOH以增强水的导电性,不能加入NaCl的原因是。发布:2025/1/3 8:0:1组卷:6引用:1难度:0.5 -
2.某种家用的消毒液的主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,下列说法错误的是( )
发布:2025/1/3 8:0:1组卷:71引用:1难度:0.7 -
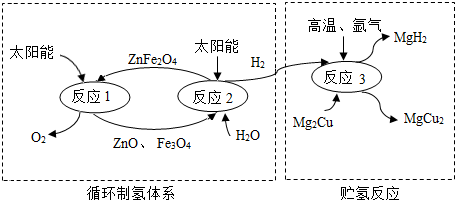 3.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5
3.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5


