淡化海水所得的浓盐水中含大量MgCl2,可制备金属镁,主要生产流程及物质转化关系如图所示,请分析过程,回答下列问题。
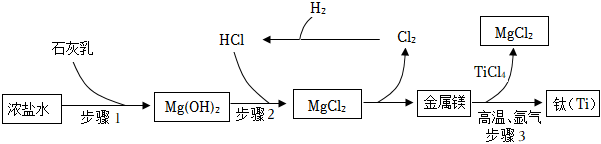
(1)步骤1中使用石灰乳,与使用石灰水相比优点:相同质量的石灰乳比石灰水中所含的氢氧化钙质量多,消耗的氯化镁的质量多,会得到更多的氢氧化镁相同质量的石灰乳比石灰水中所含的氢氧化钙质量多,消耗的氯化镁的质量多,会得到更多的氢氧化镁。
(2)利用步骤3可制得钛等物质,其反应的化学方程式:2Mg+TiCl4高温 氩气
2MgCl2+Ti2Mg+TiCl4高温 氩气
2MgCl2+Ti。
(3)步骤3中通入氩气的作用是 隔绝氧气,防止金属被氧化隔绝氧气,防止金属被氧化,该流程中可循环利用的物质为 MgCl2、HClMgCl2、HCl。
(4)淡化海水可采用如图膜分离法,其原理是水分子可以通过淡化膜进入左侧的淡水池,而海水中体积较大的盐的离子和其他分子不能通过淡化膜,从而得到淡水。下列说法中不正确的是 DD。
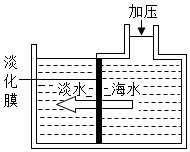
A.膜分离法的原理与滤纸过滤的原理类似
B.膜分离法还可以浓缩海水中的盐类物质
C.膜分离法也是一种分离混合物的方法
D.使用膜分离法的目的是除去海水中的不溶物
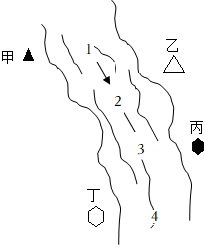
(5)如图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种。某同学对1、2、3、4处水质监测是记录了以下现象。
2
M
g
+
T
i
C
l
4
高温 |
氩气 |
2
M
g
C
l
2
+
T
i
2
M
g
+
T
i
C
l
4
高温 |
氩气 |
2
M
g
C
l
2
+
T
i
| 1 | 2 | 3 | 4 | |
| 记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
①根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是
AD
AD
;A.甲:碳酸钠
B.乙:氯化铜
C.丙:盐酸
D.丁:氢氧化钠
②若要检验甲厂排出的废水的酸碱性,可以选择的试剂是
紫色石蕊溶液
紫色石蕊溶液
;③2处的化学方程式是
2NaOH+CuCl2=Cu(OH)2↓+2NaCl
2NaOH+CuCl2=Cu(OH)2↓+2NaCl
。【答案】相同质量的石灰乳比石灰水中所含的氢氧化钙质量多,消耗的氯化镁的质量多,会得到更多的氢氧化镁;
;隔绝氧气,防止金属被氧化;MgCl2、HCl;D;AD;紫色石蕊溶液;2NaOH+CuCl2=Cu(OH)2↓+2NaCl
2
M
g
+
T
i
C
l
4
高温 |
氩气 |
2
M
g
C
l
2
+
T
i
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/18 8:0:9组卷:33引用:2难度:0.6
相似题
-
1.新冠肺炎疫情防控期间,西安市各学校开展全域喷洒低浓度、有效成分是次氯酸钠的“84”消毒液进行消毒。如图所示是模拟制备“84”消毒液的流程(Cl2是一种黄绿色的有毒气体)。请回答下列问题:
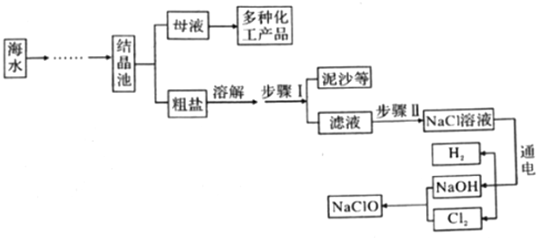
(1)NaOH的俗称为(写一种)。
(2)步骤Ⅱ中,通常用碳酸钠溶液除去滤液中的氯化钙杂质,请写出有关反应的化学方程式。
(3)电解水时,一般在水中加入少量NaOH以增强水的导电性,不能加入NaCl的原因是。发布:2025/1/3 8:0:1组卷:6引用:1难度:0.5 -
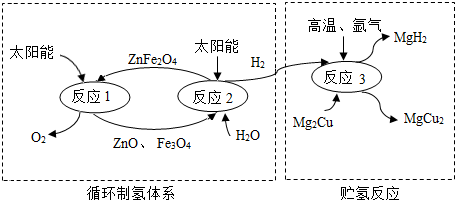 2.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5
2.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5 -
3.某种家用的消毒液的主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,下列说法错误的是( )
发布:2025/1/3 8:0:1组卷:71引用:1难度:0.7


