当前位置:
试题详情
空气吹出法是目前“海水提溴”使用的主要方法之一。其工艺流程如图。
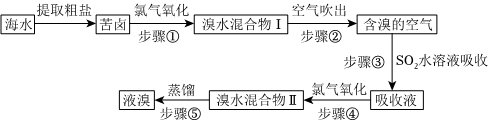
(1)步骤③所发生反应的离子方程式是 SO2+Br2+2H2O=4H++SO2-4+2Br-SO2+Br2+2H2O=4H++SO2-4+2Br-。
(2)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过 溴化铁(或其他含Br-的盐类物质)溴化铁(或其他含Br-的盐类物质)(填化合物名称)溶液,以除去氯气。
(3)步骤⑤的蒸馏过程中,温度应控制在80~90℃。过高或过低都不利于生产,请解释原因:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低。
(4)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 酸化可抑制Cl2、Br2与水反应酸化可抑制Cl2、Br2与水反应。
(5)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低。
SO
2
-
4
SO
2
-
4
【考点】从海水中提取溴;溴及其化合物的综合应用.
【答案】SO2+Br2+2H2O=4H+++2Br-;溴化铁(或其他含Br-的盐类物质);温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;酸化可抑制Cl2、Br2与水反应;空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/24 8:0:9组卷:11引用:1难度:0.5
相似题
-
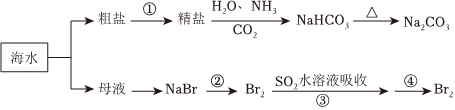
1.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
 发布:2024/12/30 3:30:1组卷:130引用:9难度:0.6
发布:2024/12/30 3:30:1组卷:130引用:9难度:0.6 -
2.海水是化学元素的宝库,从海水中可以提取或生产多种化工原料,如食盐、氯气、单质溴、镁、纯碱等,它们在工农业生产中有着广泛的用途.根据学过的知识回答下列问题:
(1)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
①其反应原理为:(用离子方程式表示).
②配制250mL 4.0mol•L-1NaOH溶液,需要用到的玻璃仪器,除烧杯、玻璃棒外,还必须用到的是.
(2)工业制得粗硅后,再与氯气等物质发生反应,最终得到纯硅.请写出工业制取粗硅的化学方程式:
(3)金属镁被誉为“国防金属”,若镁起火,不能用CO2来灭火,其原因可用化学方程式表示为
(4)①若Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是,
②若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是.发布:2024/10/27 17:0:2组卷:11引用:1难度:0.5 -
3.海水资源开发利用的部分过程如图所示:
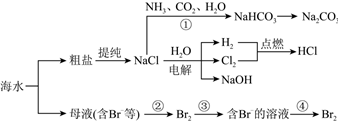
下列说法正确的是( )发布:2024/11/3 6:0:1组卷:51引用:3难度:0.7


