氯气在工业生产中有重要的用途。某课外活动小组利用下列装置在实验室中制备氯气,并进行有关氯气性质的研究。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2OMnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O;已知浓盐酸的质量分数为36.5%,密度为1.15g/mL,则该浓盐酸的物质的量浓度是 11.5mol/L11.5mol/L;浓盐酸起酸性作用和还原剂作用的物质的量之比为 1:11:1。
②选择装置,将各仪器按先后顺序连接起来,应该是a→d→e→f→g→b→cd→e→f→g→b→c→h(用导管口处的字母表示)。
(2)装置C中饱和食盐水的作的作用是 除去Cl2中的HCl除去Cl2中的HCl。
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:Cl2+2OH-=ClO-+Cl-+H2OCl2+2OH-=ClO-+Cl-+H2O,实验结束后检验E中溶液含有氯离子的实验操作是 取E中溶液少许于试管中,向其中加入足量的稀硝酸酸化,再加硝酸银溶液,若产生白色沉淀,则说明E中含有Cl-取E中溶液少许于试管中,向其中加入足量的稀硝酸酸化,再加硝酸银溶液,若产生白色沉淀,则说明E中含有Cl-。
(4)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。

①G中的现象是 溶液变蓝溶液变蓝,原因是 2KI+Cl2=2KCl+I22KI+Cl2=2KCl+I2(用化学方程式表示)。
②H中溶液变浑浊,原因是 SO2+2H2O+Cl2=4H++SO2-4+2Cl-SO2+2H2O+Cl2=4H++SO2-4+2Cl-,SO2-4+Ba2+=BaSO4↓SO2-4+Ba2+=BaSO4↓(用离子方程式表示)。
△
△
S
O
2
-
4
S
O
2
-
4
S
O
2
-
4
S
O
2
-
4
【答案】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;11.5mol/L;1:1;d→e→f→g→b→c;除去Cl2中的HCl;Cl2+2OH-=ClO-+Cl-+H2O;取E中溶液少许于试管中,向其中加入足量的稀硝酸酸化,再加硝酸银溶液,若产生白色沉淀,则说明E中含有Cl-;溶液变蓝;2KI+Cl2=2KCl+I2;SO2+2H2O+Cl2=4H+++2Cl-;+Ba2+=BaSO4↓
△
S
O
2
-
4
S
O
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/26 0:0:1组卷:7引用:1难度:0.5
相似题
-
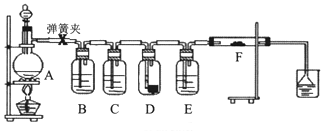
1.为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如图.其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸.干燥红色布条、浓硫酸、湿润红色布条.
请回答:
(1)E中浓硫酸的作用.
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是.
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有.
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量.发布:2025/1/15 8:0:2组卷:17引用:1难度:0.3 -
2.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
 发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8
发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8 -
3.实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图,下列说法不正确的是( )
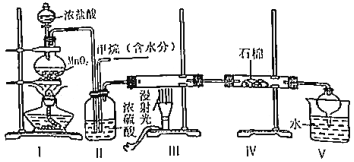 发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7
发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7


