像科学家一样思考
(1)获取物质
现有如下仪器:

①实验室中用大理石和稀盐酸反应制取二氧化碳。若要组装一套二氧化碳的发生和收集装置,可选择上图中的(填写仪器下方的字母) ACDFACDF,选择该发生装置的依据是 反应物为固体和液体,不需要加热反应物为固体和液体,不需要加热,用该方法收集二氧化碳,是因为具有的性质是 二氧化碳的密度比空气大二氧化碳的密度比空气大。用该发生装置还可以制取的气体是(填一种) 氧气(合理即可)氧气(合理即可)。写出反应的化学方程式 2H2O2 MnO2 2H2O+O2↑2H2O2 MnO2 2H2O+O2↑。
②若要检验所得的气体是二氧化碳,反应的原理是(用化学方程式表示) CO2+Ca(OH)2=CaCO3↓+H2OCO2+Ca(OH)2=CaCO3↓+H2O。
(2)研究化学反应速率的影响因素
大理石产地不同,成分也不尽相同。实验小组的同学们要探究大理石与盐酸反应中,盐酸的浓度对反应速率的影响,请你参与其中。仪器自选,请完成下表:
M
n
O
2
M
n
O
2
| 你的猜想 | 实验方案 |
|
在一定浓度范围内,盐酸浓度越大,反应速率越快(合理即可) 在一定浓度范围内,盐酸浓度越大,反应速率越快(合理即可)
|
取甲、乙两根试管,分别加入20g5%的稀盐酸和20g15%的稀盐酸,往两根试管中分别加入2g块状大理石,观察气泡的产生速率(合理即可) 取甲、乙两根试管,分别加入20g5%的稀盐酸和20g15%的稀盐酸,往两根试管中分别加入2g块状大理石,观察气泡的产生速率(合理即可)
|
将13g某地大理石(杂质不与酸反应)与80g足量的稀盐酸充分反应,待无气泡产生时,称得剩余物质的总质量为88.6g。根据化学方程式计算该地大理石中碳酸钙的质量分数
76.9%
76.9%
(计算结果保留至1%)。
【答案】ACDF;反应物为固体和液体,不需要加热;二氧化碳的密度比空气大;氧气(合理即可);2H2O2 2H2O+O2↑;CO2+Ca(OH)2=CaCO3↓+H2O;在一定浓度范围内,盐酸浓度越大,反应速率越快(合理即可);取甲、乙两根试管,分别加入20g5%的稀盐酸和20g15%的稀盐酸,往两根试管中分别加入2g块状大理石,观察气泡的产生速率(合理即可);76.9%
M
n
O
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/29 8:0:10组卷:43引用:2难度:0.5
相似题
-
1.实验室制取气体所需的装置如图所示,请回答以下问题。
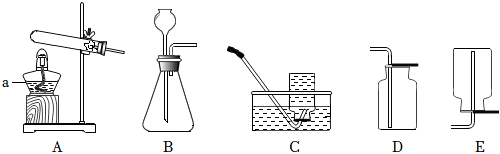
(1)a仪器名称。收集氧气可以选用C,原因是。用高锰酸钾制氧气,反应的化学方程式为。
(2)实验室用石灰石和稀盐酸制取CO2,发生装置应选用,收集用,CO2的验满方法为。发布:2024/12/8 10:30:2组卷:50引用:4难度:0.5 -
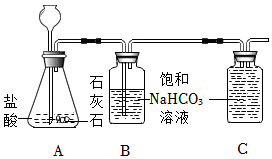 2.实验室可用如图装置制取二氧化碳;已知常温下CO2滩溶于饱和NaHCO3溶液。
2.实验室可用如图装置制取二氧化碳;已知常温下CO2滩溶于饱和NaHCO3溶液。
(1)写出A装置中发生反应的化学方程式。
(2)B中饱和碳酸氢钠溶液的作用是什么?
(3)利用排饱和NaHCO3溶液法可以收集较纯净的二氧化碳气体,请将C装置中的导管补画完整。发布:2024/12/25 15:0:2组卷:7引用:2难度:0.6 -
3.用图-1所示装置制取干燥的CO2,并对CO2的部分性质进行探究。
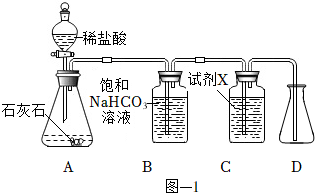
(1)装置A中发生反应的化学方程式为。
(2)①装置B中饱和NaHCO3溶液的作用是。
②装置C中试剂X应该选用(填字母)。
a.稀H2SO4
b.浓H2SO4
c.KOH溶液
(3)收集CO2并验满。将集满CO2的锥形瓶与盛有足量NaOH溶液的注射器和传感器密封连接,缓慢的将NaOH溶液注入到锥形瓶中,采集信息形成图像。见图-2。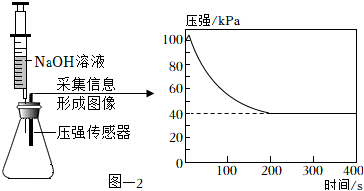
①检验装置D中CO2已经集满的方法是。
②随着反应的进行,锥形瓶中压强降低的原因是。
③反应结束后锥形瓶中的压强保持在40kPa说明。
(4)取2mL饱和澄清石灰水于试管中,用4mL蒸馏水稀释,向其中缓慢通入足量CO2。测定反应体系的电导率变化如图-3所示。(忽略反应前后溶液体积的变化)
【查阅资料】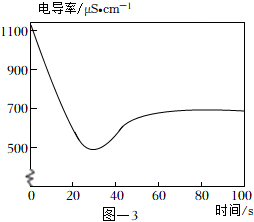
材料一:溶液的导电能力越强,溶液的电导率越大。
材料二:单位体积溶液中某离子的个数越多,则该离子的浓度越大,溶液的导电能力越强。相同浓度的不同离子导电能力不同。
材料三:Ca( OH)2溶于水能完全解离出Ca2+和OH-。
CaCO3遇到溶有CO2的水时,能反应生成易溶于水的Ca( HCO3)2,Ca( HCO3)2在水中能完全解离出Ca2+和。HCO-3
①石灰水中通入CO2气体,溶液的电导率先逐渐降低的主要原因是。
②反应最终电导率的稳定值低于初始值的可能原因是、。发布:2024/12/25 13:0:1组卷:835引用:3难度:0.6


