为解决二氧化锰催化过氧化氢制氧气后二氧化锰难回收再利用的问题,研究小组制备了水泥负载二氧化锰催化剂,探究水泥负载二氧化锰对过氧化氢分解速率的影响。
【查阅资料】
a.水泥负载二氧化锰催化剂是将二氧化锰与水泥按照一定比例混合,加水搅拌制成的一种块状催化剂。
b.可通过测定反应过程中密闭容器的压强变化值来衡量过氧化氢分解速率,压强变化值越大,说明过氧化氢分解速率越快。
【进行实验】
每次实验时均向反应容器中加入5mL过氧化氢溶液并采集相同时间内的压强变化值,记录如下:
| 实验序号 | 过氧化氢溶液浓度/% | 水泥与二氧化锰的质量比 | 水泥负载二氧化锰的质量/g | 压强变化值/kPa |
| ① | 5 | 1:1 | 0.5 | 7.92 |
| ② | 5 | 1:2 | 0.5 | 11.98 |
| ③ | 5 | 1:3 | 0.5 | 15.82 |
| ④ | 8 | 1:2 | 0.5 | 23.26 |
| ⑤ | 11 | 1:2 | 0.5 | 31.47 |
| ⑥ | 5 | 1:2 | 0.3 | 13.22 |
| ⑦ | 5 | 1:2 | 0.1 | 10.78 |
| ⑧ | 5 | 1:2 | 0 | 0.02 |
(1)水泥负载二氧化锰属于
混合物
混合物
(填“纯净物”或“混合物”)。(2)水泥负载二氧化锰催化过氧化氢分解的符号表达式为
H2O2H2O+O2
水泥负载二氧化锰
H2O2H2O+O2
。水泥负载二氧化锰
(3)依据表中数据回答,⑦中压强变化值比⑧大的原因是
水泥负载二氧化锰能使过氧化氢快速分解,相同时间内生成的氧气更多
水泥负载二氧化锰能使过氧化氢快速分解,相同时间内生成的氧气更多
。(4)对比实验①②③,得出的结论是
其他条件相同的情况下,水泥与二氧化锰的质量比越小,催化效果越好
其他条件相同的情况下,水泥与二氧化锰的质量比越小,催化效果越好
。(5)探究等体积过氧化氢溶液中,过氧化氢溶液浓度对过氧化氢分解速率的影响的实验是
④⑤
④⑤
(填实验序号)。【反思与评价】
(6)依据表中数据回答,不能得出“过氧化氢溶液浓度、水泥与二氧化锰的质量比相同时,水泥负载二氧化锰的质量越大,过氧化氢分解速率越快”的实验结论,其证据是
过氧化氢溶液浓度、水泥与二氧化锰的质量比相同,水泥负载二氧化锰的质量为0.1g、0.3g、0.5g时,对应的压强变化值为:10.78、13.22、11.98
过氧化氢溶液浓度、水泥与二氧化锰的质量比相同,水泥负载二氧化锰的质量为0.1g、0.3g、0.5g时,对应的压强变化值为:10.78、13.22、11.98
。【答案】混合物;H2O2H2O+O2;水泥负载二氧化锰能使过氧化氢快速分解,相同时间内生成的氧气更多;其他条件相同的情况下,水泥与二氧化锰的质量比越小,催化效果越好;④⑤;过氧化氢溶液浓度、水泥与二氧化锰的质量比相同,水泥负载二氧化锰的质量为0.1g、0.3g、0.5g时,对应的压强变化值为:10.78、13.22、11.98
水泥负载二氧化锰
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/31 8:0:9组卷:33引用:3难度:0.7
相似题
-
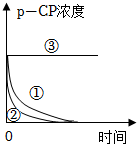 1.Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表)。
1.Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表)。
(1)请结合上述介绍将表中空格补充完整。
(2)实验测得p-CP的浓度随时间变化的关系如图所示,根据实验①、②图像可得出结论:实验编号 实验目的 温度/℃
pH浓度/(mg•L﹣1) H2O2 Fe2+ ① 为②③提供参照 25 3 204 16.8 ② 探究温度对降解反应速率的影响
3 204 16.8 ③ 探究溶液pH对降解反应速率的影响 25 10 204 16.8 。
(3)为测定不同时间内有机物降解的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据本题信息,将样品从反应器中取出后应立即将其放入某药品中,反应会迅速停止,该药品可能是。
A盐酸溶液 B氢氧化钠溶液 C稀硫酸溶液 D碳酸钠溶液发布:2024/11/25 8:0:2组卷:3引用:0难度:0.3 -
2.据图1装置图回答问题
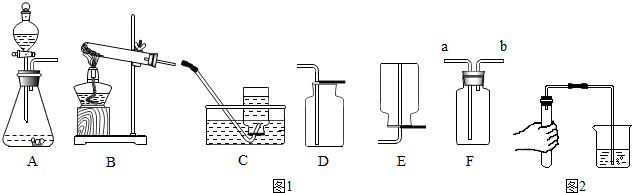
(1)甲同学用氯酸钾和二氧化锰共热制备和收集氧气,他应选用的气体发生装置是(填序号).他用装置C来收集的原因是,当看到导管口的时他才开始收集氧气.
(2)该同学用如图2所示的方法进行气密性检查,如果装置不漏气,可以看到,将手松开一段时间后(导管仍插入水中),可以看到导管中会形成一段水柱.
(3)因为氧气的密度比空气的稍大,所以还可以选用(填序号)来收集氧气,其验满的方法是.
(4)老师提醒可以用F(万能瓶)来收集气体,则甲同学应将发生装置的导管与F的导管(选填a或b)相连接.
(5)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,这位同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想Ⅰ:反应生成的二氧化锰(MnO2)分解放出O2;
猜想Ⅱ:反应生成的锰酸钾(K2MnO4)分解放出O2;
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想(选填Ⅰ或Ⅱ)错误;
第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是.
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?.
(6)丙同学选择用双氧水和二氧化锰混合来制氧气,则他应选用的气体发生装置是(填序号).以下是他探究影响该反应速率因素的相关实验数据.
通过以上实验数据的分析,可知,过氧化氢分解制氧气的化学反应速率与实验
序号H2O2溶液浓度% H2O2溶液体积/mL 温度℃ MnO2用量/g 收集到的
氧气体积/mL反应所需的
时间/s① 5 1 20 1 30.29 ② 5 1 20 0.1 4 16.75 ③ 15 1 20 0.1 4 6.04 ④ 30 1 55 2 10.76 、、等因素有关;发生装置中的(填仪器名称)也可以帮助控制反应的速率.发布:2024/12/18 8:0:1组卷:12引用:2难度:0.5 -
3.下列探究影响化学反应速率因素的实验中,实验方案正确的是( )
选项 影响因素 实验方案 A 接触面积 将1g块状石灰石和20mL10%的稀盐酸、1g粉末状石灰石与20mL10%的稀硫酸混合,比较产生气泡的快慢 B 催化剂的种类 将0.5g二氧化锰、1g氧化铁分别与10mL6%的过氧化氢溶液混合,比较产生气泡的快慢 C 反应物的种类 分别将木炭在空气中、氧气中燃烧,比较反应的剧烈程度 D 反应物的性质 分别用酒精灯加热表面积相同的镁片和铁片,比较在空气中能否被点燃 发布:2024/12/25 13:0:1组卷:114引用:4难度:0.7


