小兰欲测量某化工厂排放的废水中硫化氢的质量分数,取足量的废水静置一段时间备用,然后往100g上层清液滴加硫酸铜溶液(H2S+CuSO4=CuS↓+H2SO4,废水中其他物质不与硫酸铜反应),实验数据如表所示,回答下列问题。
| 硫酸铜溶液的质量/g | 10 | 20 | 30 | 40 | 50 |
| 生成沉淀的质量/g | 1.2 | 2.4 | 3.6 | 4.56 | 4.56 |
②
②
(选填序号)。①乙醇
②甲烷
③氢氧化钙
④二氧化碳
(2)化工厂排放的废水中硫化氢的质量分数(结果精确到0.01%)。
(3)滴加CuSO4溶液为
38
38
g时,沉淀刚好完全。(4)用化学方程式解释氢硫酸(硫化氢的水溶液易被氧化)需要密封保存的原因:
2H2S+O2=2H2O+2S↓
2H2S+O2=2H2O+2S↓
。据此,可以判断本次实验测量值将会 偏小
偏小
(选填“偏大”“不变”或“偏小”)。(5)假如你生活的地方不幸发生大量硫化氢泄漏的事故,请你说出一种有效逃生的方法:
用毛巾浸取肥皂水捂住口鼻迅速离开
用毛巾浸取肥皂水捂住口鼻迅速离开
。【答案】②;38;2H2S+O2=2H2O+2S↓;偏小;用毛巾浸取肥皂水捂住口鼻迅速离开
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/3 8:0:9组卷:23引用:2难度:0.5
相似题
-
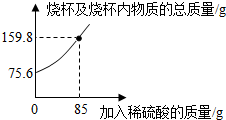 1.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为52.2g的烧杯中,然后缓慢加入一定质量的稀硫酸,当加稀硫酸质量为85g时,反应恰好完全(杂质不反应且产生的气体全部逸出),反应过程中的质量关系如图.完成下列问题:
1.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为52.2g的烧杯中,然后缓慢加入一定质量的稀硫酸,当加稀硫酸质量为85g时,反应恰好完全(杂质不反应且产生的气体全部逸出),反应过程中的质量关系如图.完成下列问题:
(1)该实验取用的样品质量为g.
(2)计算样品中铁的质量分数(写出解题过程).发布:2025/1/9 8:0:2组卷:139引用:39难度:0.1 -
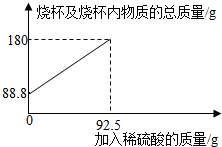 2.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入92.5g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图。
2.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入92.5g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图。
(1)该实验取用的样品质量为g。
(2)反应后所得溶液中的溶质的质量分数。(写出计算过程,结果保留一位小数)
(3)反应结束后,小明不慎向烧杯中多加了10g稀硫酸,若在图中补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的(填:上方、下方或线上)。发布:2025/1/9 8:0:2组卷:4引用:1难度:0.3 -
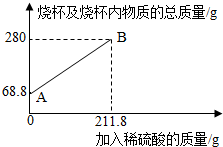 3.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入211.8g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图。
3.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入211.8g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图。
(1)该实验取用的样品质量为g。
(2)求样品中铁的质量分数;反应后所得溶液中的溶质的质量分数。(写出计算过程,结果保留一位小数)
(3)反应结束后,小明不慎向烧杯中多加了20g稀硫酸,若在图中补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的(填:上方、下方或线上)。发布:2025/1/9 8:0:2组卷:8引用:1难度:0.3
相关试卷


