查阅一款新型清洁产品“爆炸盐”的说明书,发现其主要有效成分为过碳酸钠。为测定爆炸盐中过碳酸钠(2Na2CO3•3H2O2)的质量分数,采用如图甲的测定实验:取样品10克溶于热水,待溶液不再产生气泡,分别测量整个装置在反应前、后的总质量,整理数据如表:

| 待测的量 | 反应前总质量 | 反应后总质量 |
| 电子天平示数(克) | 213.66 | 212.70 |
2Na2CO3•3H2O2═2Na2CO3+3H2O2,2H2O2
△
(1)上述过程中产生的氧气,需要分解多少克的过氧化氢(H2O2)才能得到?
(2)若图甲实验中不使用干燥装置,直接让容器敞口完成上述测量实验,将导致过碳酸钠质量分数的测量值
偏大
偏大
。(3)“爆炸盐”去污源于H2O2分解产生活性氧,若产氧过快会使易掉色的衣物出现褪色,图乙为小组同学在老师的指导下,测出图甲中产氧速度随时间变化及反应产热导致温度变化的关系图,结合图乙,提出一项措施来减少“爆炸盐”对衣物的褪色作用,并从图乙中寻找证据来支持你所提出的措施的合理性:
水量一定时,减少爆炸盐的用量,12-14分钟温度在升高,但随着反应物浓度降低,产生氧气的速度减小
水量一定时,减少爆炸盐的用量,12-14分钟温度在升高,但随着反应物浓度降低,产生氧气的速度减小
。【答案】偏大;水量一定时,减少爆炸盐的用量,12-14分钟温度在升高,但随着反应物浓度降低,产生氧气的速度减小
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/20 8:0:9组卷:63引用:1难度:0.5
相似题
-
1.小金为测定某样品中氧化铜的质量分数,称量固体样品20.0克,用如图所示的装置进行实验(杂质不参与反应且生成水完全被吸收),实验中共消耗0.6克氢气,测得B装置反应前后的质量增加了3.6克。
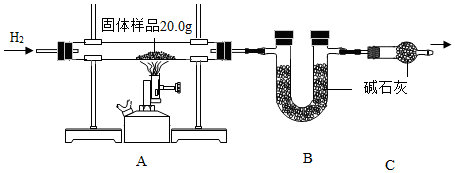
(1)C装置的作用是;
(2)计算固体样品中氧化铜的质量分数(根据化学方程式列式计算)。发布:2024/12/28 15:30:1组卷:12引用:2难度:0.5 -
 2.绍兴盛产一种四角菱,称“驮背白”。其菱肉富含淀粉等多种营养物质,此外菱角的茎和根富含纤维素(C6H10O5)n,也是一种很不错的食物和药材。
2.绍兴盛产一种四角菱,称“驮背白”。其菱肉富含淀粉等多种营养物质,此外菱角的茎和根富含纤维素(C6H10O5)n,也是一种很不错的食物和药材。
(1)菱肉中的钙、磷、铁等元素是以(填“单质”或“化合物”)的形态存在;
(2)该纤维素中C、H、O元素的质量比(最简比);
(3)查阅资料获悉菱肉制成的菱粉质细爽滑,为淀粉中之佳品。求菱叶产生3.6千克淀粉[有机物(CH2O)n]的同时,光合作用产生氧气多少千克?(已知光合作用的化学方程式为:nCO2+nH2O═(CH2O)n+nO2,条件忽略)发布:2025/1/6 8:0:1组卷:4引用:1难度:0.5 -
3.侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下:NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl,请回答:
(1)反应产物中NH4C1可以用于农业生产,它属于化肥中的肥。
(2)生产16.8t碳酸氢钠,理论上需要氯化钠的质量是多少?发布:2024/12/28 15:30:1组卷:12引用:2难度:0.5


