氮元素对动植物有重要作用,研究氮的循环和转化对生产、生活有重要的价值。
Ⅰ.(1)在实验室中由固体物质制取并收集一瓶干燥的氨气,选择图中的装置,其连接顺序为 bb→hh→gg→dd→cc→i(按气流方向表示导管连接顺序),仪器E中的碱石灰 不能不能(填“能”或“不能”)用无水CaCl2替代。
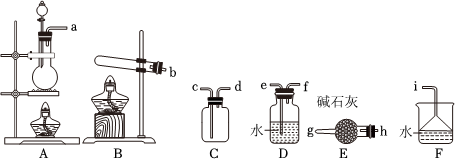
Ⅱ.氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
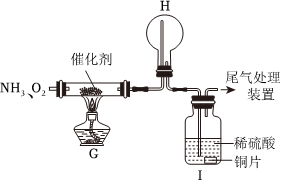
(2)一段时间后,观察到装置H中有白烟生成,该白烟成分是 NH4NO3NH4NO3(写化学式)。
(3)再经过一段时间观察到装置Ⅰ中溶液变成蓝色,用离子方程式解释装置Ⅰ中溶液变成蓝色的原因是 3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O。
(4)工业生产中为了盛装大量浓硝酸,可以用 BB(填标号)作为罐体材料;
A.镁
B.铁
C.锌
D.铜
此罐体材料的金属在工业上常采用冶炼的方法为 CO还原赤铁矿CO还原赤铁矿。
Ⅲ.将反应3O2+4NH3═2N2+6H2O设计成原电池,其装置示意图如图(A、B为铂电极)。
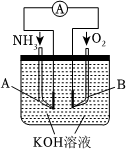
(5)该电池的正极为 BB(填“A”或B)电极,负极的电极反应式为 2NH3-6e-+6OH-=N2+6H2O2NH3-6e-+6OH-=N2+6H2O,反应进行一段时间,溶液的碱性 减弱减弱(填“增强”、“减弱”或“不变”)。
(6)下列含氮物质参与的变化中属于吸热反应的是 ①①(填标号)。
①氢氧化钡与氯化铵混合后搅拌
②氨的催化氧化
③铜与浓硝酸的反应
④硝酸铵固体投入水中
NO
-
3
NO
-
3
【答案】b;h;g;d;c;不能;NH4NO3;3Cu+8H++2=3Cu2++2NO↑+4H2O;B;CO还原赤铁矿;B;2NH3-6e-+6OH-=N2+6H2O;减弱;①
NO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/6 8:0:9组卷:40引用:1难度:0.5