Ⅰ.离子反应是中学化学中重要的反应类型。请回答下列问题:
(1)溶液中只存在四种离子,各离子个数比为Cl-:SO2-4:Fe3+:M=2:2:3:3,(不考虑水的电离),则M为 DD。
A.OH-
B.Mg2+
C.Na+
D.NO-3
Ⅱ.某溶液仅由Na+、Cu2+、Ba2+、Fe3+、CO2-3、SO2-4、Cl-中的若干种离子组成,取适量溶液进行如图1实验:
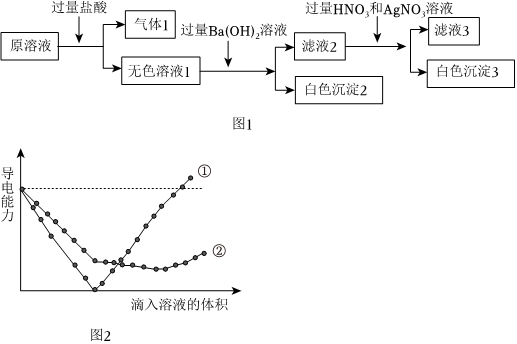
(2)根据以上实验判断,溶液中肯定存在的离子有 CO2-3、Na+、SO2-4CO2-3、Na+、SO2-4:肯定不存在的离子有 Cu2+、Ba2+、Fe3+Cu2+、Ba2+、Fe3+。
(3)少量的气体1通入澄清石灰水的离子反应方程式 CO2+2OH-+Ca2+=CaCO3↓+H2OCO2+2OH-+Ca2+=CaCO3↓+H2O。
Ⅲ.某兴趣小组同学向一定体积Ba(OH)2溶液逐滴加入NaHSO4溶液。
(4)能正确表示溶液导电能力随滴入溶液体积变化的是曲线(图2)②②(填①或②)
(5)向一定体积Ba(OH)2溶液滴加NaHSO4至中性,涉及的离子反应方程式 Ba2++2OH-+2H++SO2-4=BaSO4↓+2H2OBa2++2OH-+2H++SO2-4=BaSO4↓+2H2O。
C
l
-
:
S
O
2
-
4
:
F
e
3
+
:
M
=
2
:
2
:
3
:
3
N
O
-
3
C
O
2
-
3
S
O
2
-
4
C
O
2
-
3
S
O
2
-
4
C
O
2
-
3
S
O
2
-
4
B
a
2
+
+
2
O
H
-
+
2
H
+
+
S
O
2
-
4
=
B
a
S
O
4
↓
+
2
H
2
O
B
a
2
+
+
2
O
H
-
+
2
H
+
+
S
O
2
-
4
=
B
a
S
O
4
↓
+
2
H
2
O
【答案】D;、Na+、;Cu2+、Ba2+、Fe3+;CO2+2OH-+Ca2+=CaCO3↓+H2O;②;
C
O
2
-
3
S
O
2
-
4
B
a
2
+
+
2
O
H
-
+
2
H
+
+
S
O
2
-
4
=
B
a
S
O
4
↓
+
2
H
2
O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/5 14:0:1组卷:25引用:3难度:0.6
相似题
-
1.某无色溶液,其中可能存在Na+、Ba2+、
、S2-、AlO-2、SO2-3.取该溶液进行有关实验,实验结果如图所示.SO2-4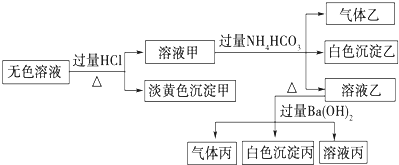
回答下列问题:
(1)沉淀甲的化学式为.
(2)由溶液甲生成沉淀乙的离子方程式为.
(3)沉淀丙中一定含有(填化学式,下同),可能含有.
(4)综合上述信息,该溶液中肯定存在的离子有.
(5)该溶液显性(填酸性、碱性或中性),若要检验其酸碱性,下图操作正确的是.
请用离子方程式表示显碱性的原因:.发布:2024/12/30 6:0:2组卷:10引用:2难度:0.3 -
2.在实验室鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取残渣;⑦用HNO3酸化。(填序号)
(1)鉴定氯酸钾中氯元素的操作步骤依次是
(2)鉴定1-氯丙烷中氯元素的操作步骤依次是。发布:2024/12/30 8:0:15组卷:67引用:8难度:0.5 -
3.为检验某种阳离子为Na-的溶液中含有的阴离子是SO42-、CO32-、OH-还是Cl-,下列设计的方案合理的是( )
发布:2024/12/30 6:30:2组卷:9引用:2难度:0.6


