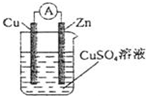
(Ⅰ)某兴趣小组的同学用下图Ⅰ所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲、乙、丙三池中为原电池的是甲池甲池 (填“甲池”、“乙池”或“丙池”)。
(2)写出甲池中A电极的电极反应式2CH3OH+16OH--12e-═CO32-+12H2O2CH3OH+16OH--12e-═CO32-+12H2O。
(3)丙池中F电极为阴极阴极 (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为2CuSO4+2H2O 通电 2H2SO4+2Cu+O2↑2CuSO4+2H2O 通电 2H2SO4+2Cu+O2↑。
(4)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为560560mL(标况)。
(5)一段时间后,断开开关K.下列物质能使丙池恢复到反应前浓度的是BCBC(填选项字母)。
A.Cu B.CuO C.CuCO3 D.Cu2(OH)2CO3
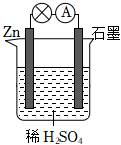
(Ⅱ)控制适合的条件,将反应2Fe3++2I-⇌2Fe2++I2,设计成如图Ⅱ所示装置。请回答下列问题:
(6)反应开始时,乙中石墨电极上发生氧化氧化(填“氧化”或“还原”)反应,电极反应式为2I--2e-=I22I--2e-=I2。盐桥中的阳阳 (填“阳”或“阴”)离子向甲溶液方向移动。
(7)电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则甲中的石墨电极的电极反应式为Fe2+-e-=Fe3+Fe2+-e-=Fe3+。
通电
通电
【考点】原电池与电解池的综合.
【答案】甲池;2CH3OH+16OH--12e-═CO32-+12H2O;阴极;2CuSO4+2H2O 2H2SO4+2Cu+O2↑;560;BC;氧化;2I--2e-=I2;阳;Fe2+-e-=Fe3+
通电
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 12:0:1组卷:54引用:2难度:0.6