回答以下关于常见元素及其化合物的问题。
(1)碘元素在元素周期表中位置 第五周期第ⅦA族第五周期第ⅦA族,碘基态原子价电子的电子排布式为 5s25p55s25p5。价电子共占据 44个轨道。
(2)(CN)2是一种与Cl2性质相似的气体,在(CN)2中C显+3价,N是-3价,氮元素显负价的原因 氮原子半径小于碳原子,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价氮原子半径小于碳原子,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价。该分子中每个原子都达到了8电子稳定结构,写出(CN)2的电子式 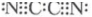
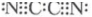 。
。
(3)请比较氮元素与氧元素的非金属性强弱:N <<O(填“>”、“<”或“=”),用一个化学方程式说明强弱关系 3O2+4NH3 △ 6H2O+2N23O2+4NH3 △ 6H2O+2N2。
(4)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是 甲醇分子间存在氢键甲醇分子间存在氢键。
(5)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中的BH-4(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 2Fe2++BH-4+4OH-=2Fe+2H2↑+B(OH)4-2Fe2++BH-4+4OH-=2Fe+2H2↑+B(OH)4-。
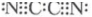
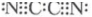
△
△
BH
-
4
BH
-
4
BH
-
4
【答案】第五周期第ⅦA族;5s25p5;4;氮原子半径小于碳原子,氮原子吸引电子的能力比碳原子强,氮和碳之间共用电子对偏向氮原子,氮显负价;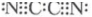 ;<;3O2+4NH3 6H2O+2N2;甲醇分子间存在氢键;2Fe2+++4OH-=2Fe+2H2↑+B(OH)4-
;<;3O2+4NH3 6H2O+2N2;甲醇分子间存在氢键;2Fe2+++4OH-=2Fe+2H2↑+B(OH)4-
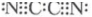 ;<;3O2+4NH3
;<;3O2+4NH3 △
BH
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/8 8:0:9组卷:49引用:2难度:0.6
相似题
-
1.下列事实中不能用来比较S、Cl非金属性的是( )
发布:2024/5/27 14:0:0组卷:116引用:2难度:0.7 -
2.下列实验操作与实验目的相符的是( )
序号 实验操作 实验目的 A 测定HF、HCl的熔点、沸点 比较F、Cl的非金属性强弱 B MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 比较镁、铝的金属性强弱 C 将SO2气体通入碳酸钠溶液中 比较碳、硫的非金属性强弱 D 向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 比较NaOH、NH3•H2O、Al(OH)3的碱性强弱 发布:2024/5/27 14:0:0组卷:80引用:4难度:0.5 -
3.下列关于元素金属性和非金属性强弱比较的说法不正确的是( )
发布:2024/5/27 14:0:0组卷:152引用:3难度:0.5


