二十一世纪是海洋开发与利用的世纪,海洋化学资源的综合利用将是重点发展领域之一。
(1)海水晒盐:将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水就会成为食盐 饱和饱和溶液(填“饱和”或“不饱和”),再晒就会逐渐析出粗盐,剩余的液体称为母液(也称卤水)。
(2)海水制镁:海水晒盐后,以其母液(卤水)提取氯化镁时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,这样做的目的是 富集提纯氯化镁富集提纯氯化镁。
(3)海水制碱:我国化学家侯德榜所创立的侯氏联合制碱法,既提高了原料利用率,又“变废为宝”,降低了生产成本,促进了世界制碱技术的发展。侯氏联合制碱法的部分工艺流程如下:
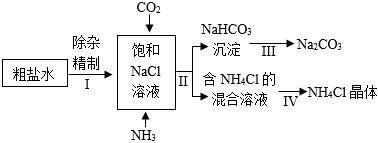
①粗盐水中主要含有Na2SO4、MgCl2、CaCl2三种可溶性杂质,工业上常用加入稍过量的 BaCl2BaCl2(填化学式,下同)溶液、NaOH溶液、Na2CO3Na2CO3溶液及适量的盐酸等除杂、精制。
②Ⅱ中发生反应的化学方程式为 NH3+NaCl+H2O+CO2=NaHCO3↓+NH4ClNH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl。
③氯化铵属于化肥中的 氮肥氮肥(填“氮肥”“磷肥”“钾肥”“复合肥”),不能与熟石灰混合施用的原因为 2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑(写化学方程式)。
④有关以下说法不正确的是 CC。
A.Ⅱ中通入氨气的目的是使溶液呈碱性,更有利于吸收二氧化碳
B.由于生成的碳酸氢钠比氯化铵的溶解度小,所以碳酸氢钠先结晶析出
C.得到的氯化铵混合溶液中含有碳酸氢钠,且为其不饱和溶液
D.Ⅲ中利用碳酸氢钠不稳定,加热分解制得纯碱,同时将热能转化为化学能
【答案】饱和;富集提纯氯化镁;BaCl2;Na2CO3;NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl;氮肥;2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑;C
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/12 8:0:8组卷:26引用:2难度:0.5
相似题
-
1.侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
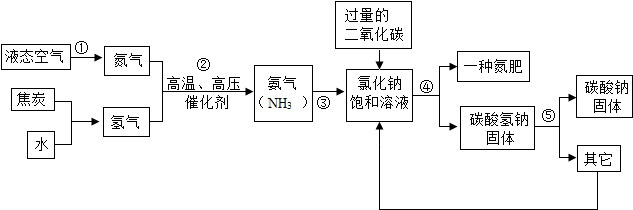
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳以及。
(2)若上述流程中,“一种氮肥”指的是一种铵态氮肥,则其化学式是。
(3)上述流程中,为了节约成本,可循环利用的物质是。发布:2024/11/15 8:0:2组卷:147引用:2难度:0.5 -
2.侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展做出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工艺流程大致如下图所示:

(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、等;
(2)上述流程中,可循环利用的物质是;
(3)上述流程中,“一种氮肥”的化学式是。发布:2024/11/15 8:0:2组卷:22引用:1难度:0.5 -
3.海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧,请根据粗盐“制碱”的流程图(如图)回答问题:
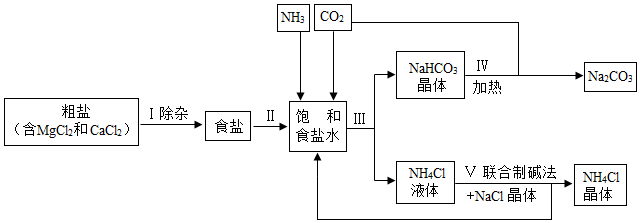
(1)步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的(填“饱和”或“不饱和”)溶液;二是化学方法,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是。
A.①Ca(OH)2②Na2CO3
B.①Na2CO3②Ca(OH)2
C.①KOH②Na2CO3
D.①NaOH②Na2CO3
(2)步骤Ⅲ先向饱和食盐水中通入氨气,再通入二氧化碳,这样做的目的是,写出步骤Ⅲ反应的化学方程式。
(3)步骤Ⅳ发生的反应属于反应(填基本反应类型)。
(4)我国化学家侯德榜创立的联合制碱法的优点有。
A.无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境
B.大大提高了食盐的利用率,节约了成本
C.将“制碱”与制氨生产联合起来,同时析出的NH4Cl晶体可用作复合肥发布:2024/12/24 10:30:2组卷:548引用:9难度:0.5


