一种在常温、常压下催化电解实现工业合成氨反应的工艺为:2N2(g)+6H2O(l)═4NH3(g)+3O2(g),ΔH1=+1530kJ⋅mol-1
该反应可分两步完成:
反应Ⅰ:N2(g)+3H2(g)═2NH3(g)ΔH2=-92.4kJ⋅mol-1
反应Ⅱ:2H2O(l)═2H2(g)+O2(g)ΔH3
请回答下列问题:
(1)ΔH3=+571.6+571.6kJ⋅mol-1。
(2)将1.00molN2和3.00molH2充入到3L的恒容密闭容器中模拟反应Ⅰ:
①该反应中物质浓度随时间变化的曲线如图甲所示,0~10min内,v(H2)=0.075mol⋅L-1⋅min-10.075mol⋅L-1⋅min-1。
②不同温度和压强下测得平衡时混合物中氨的体积分数与温度的关系如图乙所示,则B、C两点的平衡常数KB==KC(填“>”、“<”、“=”或“不确定”);B点时N2的转化率=82%82%(保留2位有效数字)。
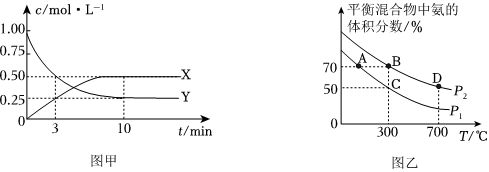
(3)从图乙中获知反应Ⅰ存在着高温降低平衡产率与低温降低反应速率等调控矛盾。在提高合成氨的产率的工业生产中,通常从以下多个视角来综合考虑合理的工业生产条件:
反应速率的视角:①加入催化剂;②提高温度(控制在催化剂的活性温度内)
平衡移动和原料的转化率的视角:③增大压强增大压强,④增大N2的浓度增大N2的浓度。
(4)科学家为避免直接破坏N≡N键而消耗大量热能,通过新型催化剂降低了反应路径中决速步的能垒(图丙),使该反应在常温、常压下采用电化学方法也能实现,反应装置如图丁所示:
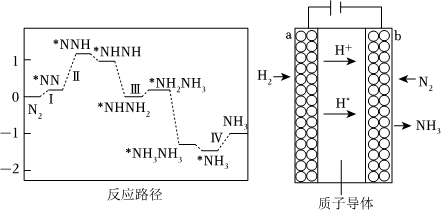
①反应路径中的决速步为 ⅡⅡ。(填写“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”)
②阴极上的电极反应式为 N2+6H++6e-═2NH3N2+6H++6e-═2NH3。
N
2
+
6
H
+
+
6
e
-
═
2
N
H
3
N
2
+
6
H
+
+
6
e
-
═
2
N
H
3
【答案】+571.6;0.075mol⋅L-1⋅min-1;=;82%;增大压强;增大N2的浓度;Ⅱ;
N
2
+
6
H
+
+
6
e
-
═
2
N
H
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/30 0:0:8组卷:22引用:1难度:0.5
相似题
-
1.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。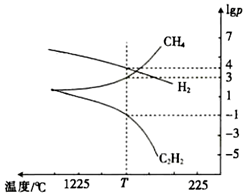
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
2.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


