造纸术是我国“古代四大发明”之一,为人类文明的发展奠定了基础。
Ⅰ.如图是古代造纸的流程图:
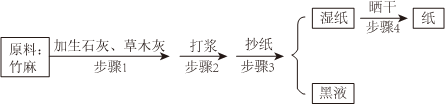
(1)古代造纸工艺步骤Ⅰ中加生石灰,草木灰,被称为“浸灰水”,目的是除去竹庭中一些造纸不需要的成分。发生的化学反应有:生石灰与水反应,化学方程式为 CaO+H2O=Ca(OH)2CaO+H2O=Ca(OH)2,该反应 放热放热(填“吸热”或“放热”)。生石灰与水反应的生成物再与草木灰(主要成分为碳酸钾)反应生成强碱氢氧化钾。
(2)氢氧化钾与氢氧化钠的化学性质相似,写出氢氧化钾与二氧化碳反应的化学方程式 2KOH+CO2=K2CO3+H2O2KOH+CO2=K2CO3+H2O。
Ⅱ.如图是现代造纸的流程图
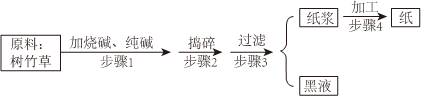
现代造纸流程中常加入氢氧化钠,使植物中的可溶物质与油脂等分离,过滤得到纸浆与黑液。黑液呈碱性,不能直接排放到水中。
【提出问题】碱性黑液中可能含有哪些物质?
【提出猜想】
猜想一:NaOH;
猜想二:Na2CO3;
猜想三:NaOH和Na2CO3
【资料卡片】Na2CO3+CaCl2=CaCO3↓+2NaCl;CaCl2溶液呈中性。
【实验探究】
(3)该兴趣小组的同学设计了以下实验方案进行了探究
| 实验步骤 | 实验操作 | 实验现象 | 实验结论 |
| 步骤一 | 取样,向其中滴加过量BaCl2溶液 | 有 白色沉淀 白色沉淀 生成 |
猜想三成立 |
| 步骤二 | 将步骤一分应后的溶液静置,取少量上层清液于试管中,滴加2-3滴无色酚酞溶液 | 酚酞溶液变为 红 红 色。 |
(4)根据对碱性黑液成分的探究,你认为可以通过加入
稀盐酸(或稀硫酸)
稀盐酸(或稀硫酸)
(填名称)和废液成分发生反应后再排放,写出其中一个化学反应的化学方程式 HCl+NaOH=NaCl+H2O(或Na2CO3+2HCl=2NaCl+H2O+CO2↑)或2NaOH+H2SO4=Na2SO4+2H2O(或Na2CO3+H2SO4=Na2SO4+H2O+CO2↑)(合理即可)
HCl+NaOH=NaCl+H2O(或Na2CO3+2HCl=2NaCl+H2O+CO2↑)或2NaOH+H2SO4=Na2SO4+2H2O(或Na2CO3+H2SO4=Na2SO4+H2O+CO2↑)(合理即可)
。(合理即可)【拓展提升】
(5)《制浆造纸工业水污染物排放标准》中要求废水的pH为6-9,可用
A
A
监测废水的酸碱度(填标号)。A.pH试纸
B.酚酞溶液
C.石蕊溶液
(6)鉴于纸厂的建厂地对于原料、运输、水、电,特别是环境污染等方面的需求,最好选在
B
B
处。(选填“A”或“B”或“C”)图中箭头是指水流方向。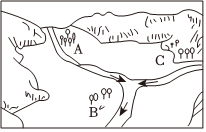
【答案】CaO+H2O=Ca(OH)2;放热;2KOH+CO2=K2CO3+H2O;白色沉淀;红;稀盐酸(或稀硫酸);HCl+NaOH=NaCl+H2O(或Na2CO3+2HCl=2NaCl+H2O+CO2↑)或2NaOH+H2SO4=Na2SO4+2H2O(或Na2CO3+H2SO4=Na2SO4+H2O+CO2↑)(合理即可);A;B
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/24 8:0:9组卷:49引用:3难度:0.5
相似题
-
 1.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
1.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
(1)米、面的主要成分都是由三种元素组成的淀粉,淀粉属于糖类.
(2)水瓶内的水垢主要成分是碳酸钙,可用(填一种调味品)除去.
(3)白糖与红糖主要成分都是蔗糖.利用活性炭的性,可将红糖脱色成白糖.
(4)市场上销售的香肠、盐水鸭、榨菜、豆腐干等食品,常采用真空包装,其目的是防止食品而变质.
(5)味精是烹制菜肴时常用的调味品,小明研究某品牌味精包装上的部分文字说明后,想测定此味精中氯化钠的含量.
[查阅资料]NaCl+AgNO3=AgCl↓+NaNO3,谷氨酸钠的存在不影响NaCl性质.
[实验过程]
①称取该味精样品10.0g,并溶于蒸馏水
②加入过量的硝酸银溶液,过滤
③用蒸馏水反复洗涤沉淀多次
④将沉淀烘干、称量,测得固体质量为5.74g
根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器除烧杯、铁架台(带铁圈)、玻璃棒外,还需要的玻璃仪器是.
②试通过计算确定此样品中NaCl质量分数与其包装上标注的含量是否相符.发布:2025/1/6 8:0:1组卷:68引用:2难度:0.5 -
2.化学兴趣小组同学们在老师的指导下对市售某品牌“钙片”的补钙原理、成分以及功效展开了项目化学习的探究。
【查阅资料】
(1)该补钙剂的主要成分有碳酸钙、维生素D3、硫酸锌、水果香料等。
(2)维生素D3、水果香料都不溶于水也不与酸反应,维生素D3主要作用是促进人体对钙的吸收。
项目一:探究“钙片”补钙原理。
【分析交流】
“钙片”中钙以碳酸钙形式存在,“钙片”进入胃首先要通过人体胃酸对其进行溶解后方可被吸收。
【进行实验】
【反思评价】服用“钙片”时,采用实验方案 实验现象 实验结论或化学方程式 取适量“钙片”粉末于试管中,滴加足量 。化学方程式 (填“吞服”或“嚼服”)的服药方式更有利促进胃肠吸收。
项目二:探究“钙片”中是否含有硫酸锌。
项目三:探究“钙片”的功效。实验方案 实验现象 实验结论 另取少量“钙片”粉末于试管中,加足量水,充分溶解,取适量上层清液于试管中,加入几滴 。“钙片”中含有硫酸锌。
【交流讨论】
该补钙剂适用于中老年人治疗因缺钙导致的患者。老师建议大家应注意平时的饮食补钙,牛奶、鱼类等食物除富含营养素外,是较好的补钙食物,应该多食用。发布:2025/1/3 16:0:5组卷:30引用:1难度:0.5 -
 3.酸、碱、盐种类繁多,与人类生活和生产关系密切。请回答下列问题:
3.酸、碱、盐种类繁多,与人类生活和生产关系密切。请回答下列问题:
(1)造纸业会产生大量含NaOH的碱性废水,需经处理至中性排放。
①写出NaOH的俗称:(一个即可)。
②若某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸9.8t(H2SO4的质量分数为10%)。可以处理的废水质量为t。
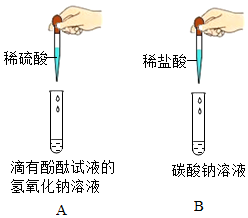
(2)某化学兴趣小组做了如图所示的两个实验。完成A、B两个实验后,同学们将实验后的废液倾倒入一个废液缸中,发现废液呈红色,小组同学对废液成分展开了如下探究。(该题实验过程中所用溶液浓度较低;氯化钙溶液和氯化钡溶液显中性;实验中如涉及硫酸钙、氢氧化钙等微溶物,均可看做可溶物)
【交流讨论】小组同学经讨论分析后一致认为废液中一定含有的溶质有氯化钠和(酚酞除外)。
【提出猜想】废液中还含有的物质:
猜想一:NaOH;
猜想二:Na2CO3;
猜想三:(填化学式)。
【实验验证】
甲同学取少量废液于试管中,向其中加入过量的氯化钙溶液,通过观察现象,得出了正确结论。若猜想二正确,甲同学观察到的现象:有白色沉淀生成,;请写出发生反应的化学方程式:。
【交流与反思】乙同学认为,将甲同学实验中的氯化钙溶液换成氯化钡溶液,也能得出正确结论。你认为乙同学的观点是否正确并说明你的理由:。发布:2025/1/3 8:0:1组卷:93引用:1难度:0.5


