氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。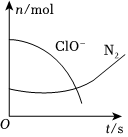
(1)氢化钠(NaH)在野外被用作生氢剂,其原理是NaH+H2O═NaOH+H2↑,该反应中氧化剂是 H2OH2O,还原剂是 NaHNaH;被氧化与被还原元素的物质的量之比为:1:11:1。
(2)某离子反应中涉及H2O、ClO-、NH+4、H+、N2、Cl-六种微粒。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是 cc。
a.该反应的氧化剂是ClO-
b.消耗1mol还原剂,转移3mol电子
c.氧化剂与还原剂的物质的量之比为2:3
d.当生成14gN2时,消耗的ClO-为1.5mol
e.氧化性:ClO->NH+4
(3)高铁酸钠(Na2FeO4),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(Na2FeO4)中铁元素的价态为 +6+6;写出制备高铁酸钠的离子方程式 2Fe3++10OH-+3ClO-=2FeO2-4+3Cl-+5H2O2Fe3++10OH-+3ClO-=2FeO2-4+3Cl-+5H2O。
N
H
+
4
N
H
+
4
F
e
O
2
-
4
F
e
O
2
-
4
【答案】H2O;NaH;1:1;c;+6;2Fe3++10OH-+3ClO-=2+3Cl-+5H2O
F
e
O
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/11 16:0:2组卷:35引用:1难度:0.6
相似题
-
1.根据下列两个反应判断:2Cu+O2=2CuO,2Cu+S=Cu2S,下列叙述中错误的是( )
发布:2024/12/30 14:30:1组卷:16引用:2难度:0.9 -
2.实验证明,在一定温度和压强下,用铜的化合物做催化剂,甲烷(CH4)与氧气反应只生成甲醇(CH3OH)。下列叙述正确的是( )
发布:2025/1/7 8:0:2组卷:2引用:1难度:0.7 -
3.将适量的SO2通入Fe(NO3)3溶液中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是( )
发布:2024/12/30 14:30:1组卷:27引用:2难度:0.6


