氯气在工业上可用于海水提溴、海带提碘。海水提溴工业流程如图1。
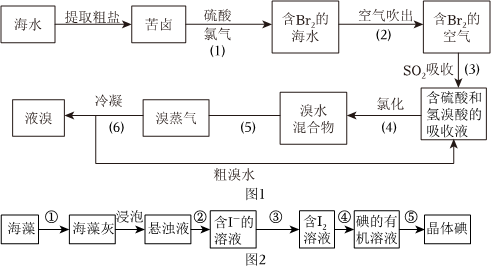
(1)步骤(1)中,加硫酸的目的是 酸化碱性的海水,抑制氯气与碱、水反应,减少氯气损耗酸化碱性的海水,抑制氯气与碱、水反应,减少氯气损耗,步骤(2)利用了溴的什么物理性质?易挥发易挥发。该空气的温度一般控制在80~90℃,温度过高有何不妥?水会大量挥发,混入溴蒸气中,不利于富集溴水会大量挥发,混入溴蒸气中,不利于富集溴。
(2)步骤(3)反应中,氧化产物是 硫酸硫酸。该反应的离子方程式为 Br2+SO2+2H2O=4H++SO2-4+2Br-Br2+SO2+2H2O=4H++SO2-4+2Br-。
(3)步骤(2)(3)(4)的目的是 富集溴,降低提取成本富集溴,降低提取成本。
(4)步骤(5)、(6)的操作名称依次为 蒸馏蒸馏、分液分液。
海藻中含有丰富的碘元素。实验室中提取碘的流程如图2:
(5)步骤①的目的是 把有机态的碘原子转化为无机态的碘离子把有机态的碘原子转化为无机态的碘离子。欲确认步骤③中的反应已发生,可取样,加 淀粉淀粉(试剂名称)。
(6)在实验室中进行步骤④操作需要的仪器是 分液漏斗、锥形瓶分液漏斗、锥形瓶。步骤⑤的名称为 蒸馏蒸馏。
(7)关于海水提溴、海藻提碘,下列说法正确的是 ADAD。(双选)
A.都需经过浓缩、氧化、提取
B.海水提溴的浓缩原理是蒸发,提高n(Br-)
C.都可通氯气将Br-、I-分别还原为Br2、I2
D.海藻提碘可采用CCl4萃取I2,海水提溴没有萃取操作
SO
2
-
4
SO
2
-
4
【答案】酸化碱性的海水,抑制氯气与碱、水反应,减少氯气损耗;易挥发;水会大量挥发,混入溴蒸气中,不利于富集溴;硫酸;Br2+SO2+2H2O=4H+++2Br-;富集溴,降低提取成本;蒸馏;分液;把有机态的碘原子转化为无机态的碘离子;淀粉;分液漏斗、锥形瓶;蒸馏;AD
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/7 9:0:2组卷:39引用:1难度:0.5
相似题
-
1.海水是化学元素的宝库,从海水中可以提取或生产多种化工原料,如食盐、氯气、单质溴、镁、纯碱等,它们在工农业生产中有着广泛的用途.根据学过的知识回答下列问题:
(1)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
①其反应原理为:(用离子方程式表示).
②配制250mL 4.0mol•L-1NaOH溶液,需要用到的玻璃仪器,除烧杯、玻璃棒外,还必须用到的是.
(2)工业制得粗硅后,再与氯气等物质发生反应,最终得到纯硅.请写出工业制取粗硅的化学方程式:
(3)金属镁被誉为“国防金属”,若镁起火,不能用CO2来灭火,其原因可用化学方程式表示为
(4)①若Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是,
②若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是.发布:2024/10/27 17:0:2组卷:11引用:1难度:0.5 -
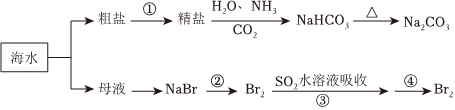
2.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
 发布:2024/12/30 3:30:1组卷:130引用:9难度:0.6
发布:2024/12/30 3:30:1组卷:130引用:9难度:0.6 -
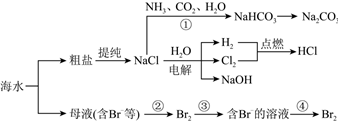
3.海水资源开发利用的部分过程如图所示:
下列说法正确的是( )发布:2024/11/3 6:0:1组卷:51引用:3难度:0.7


