食醋的有效成分主要为醋酸(用HAc表示).25℃时,HAc的,Ka=1.75×10-5=10-4.76.某小组研究25℃下HAc电离平衡的影响因素.提出假设:稀释HAc溶液或改变AC-浓度,HAc电离平衡会发生移动.设计方案并完成实验:用浓度均为0.1mol•L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液:测定pH,记录数据.
| 序号 | V(HAc)/mL | V(HAc)/mL | V(HAc)/mL | n(NaAc):n(HAc) | pH |
| Ⅰ | 40.00 | 0 | 2.86 | ||
| Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
| ••• | |||||
| Ⅶ | 4.00 | a | b | 3:4 | 4.53 |
| Ⅷ | 4.00 | 4.00 | 32.00 | 1:1 | 4.65 |
250mL容量瓶和量筒
250mL容量瓶和量筒
.(2)根据表中信息,补充数据:a=
3.00
3.00
,b=33.00
33.00
.(3)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡
正
正
(填“正”或“逆”)向移动;结合表中数据,给出判断理由:实验Ⅱ相较于实验I,醋酸溶液稀释了10倍,而实验II的pH增大值小于1
实验Ⅱ相较于实验I,醋酸溶液稀释了10倍,而实验II的pH增大值小于1
.查阅资料获悉:一定条件下,按
n
(
N
a
A
c
)
n
(
HA
c
)
(4)用移液管取20.00mLHAc溶液于锥形瓶中,加入2滴酚酞溶液,用0.1000mol/LNaOH溶液滴定至终点,判断滴定至终点的现象是
滴入最后半滴标准液时,溶液由无色变成浅红色,且半分钟内不褪色
滴入最后半滴标准液时,溶液由无色变成浅红色,且半分钟内不褪色
.(5)若测定结果偏低,可能原因是
CD
CD
(双选).A.滴定管用蒸馏水洗净后未用氢氧化钠润洗
B.盛装待测液的锥形瓶水洗后未烘干
C.滴定过程中振荡锥形瓶时不慎有少量液体溅出
D.滴定前滴定管内无气泡,滴定后滴定管内出现气泡
NaClO溶液具有漂白能力,已知25℃时,Ka(HClO)=4.0×10-8,向含有NaOH的NaClO溶液中逐滴滴入FeSO4溶液,滴加过程中溶液的pH随FeSO4溶液的体积的变化曲线及实验现象见下表.
| 变化曲线 | 实验现象 |
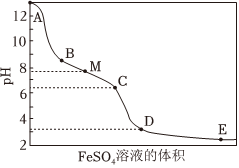 |
ⅰ.A→B产生红褐色沉淀 ⅱ.B→C红褐色沉淀的量增多 ⅲ.C→D红褐色沉淀的量增多 ⅳ.D点附近产生有刺激性气味的气体 ⅴ.D→E红褐色沉淀的量略有增多 |
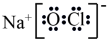
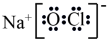
[Na+]>[ClO−]>[OH−]>[H+]
[Na+]>[ClO−]>[OH−]>[H+]
.25℃,pH=7.0的NaClO和HClO的混合溶液中,[HClO]>
>
[ClO-](填<,>或=).(7)某温度下,CuS和Ag2S饱和溶液中pS和pM的关系如图所示,其中pS=-lg[S2-],PM=-lg[Mn+],pS=-lg[S2-],PM=-lg[Mn+],Mn+为Cu2+或Ag+,下列说法错误的是
D
D
(单选).
A.曲线Ⅱ代表的是Ag2S
B.a=49
C.此温度下CuS的Ksp=1×10-36
D.此温度下的饱和溶液中[CuS]>[Ag2S]
【答案】250mL容量瓶和量筒;3.00;33.00;正;实验Ⅱ相较于实验I,醋酸溶液稀释了10倍,而实验II的pH增大值小于1;滴入最后半滴标准液时,溶液由无色变成浅红色,且半分钟内不褪色;CD; ;[Na+]>[ClO−]>[OH−]>[H+];>;D
;[Na+]>[ClO−]>[OH−]>[H+];>;D
 ;[Na+]>[ClO−]>[OH−]>[H+];>;D
;[Na+]>[ClO−]>[OH−]>[H+];>;D【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/21 1:0:8组卷:36引用:2难度:0.5


