我国古代“布灰种盐”生产海盐的主要过程为“烧草为灰色。布在滩场,然后以海水渍之,侯晒结浮白,扫而复淋”。
①“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,该过程和实验操作 蒸发蒸发的原理相似。
②经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数约为15%),从燃料利用角度分析,煎炼海盐选用的是 上等卤水上等卤水(选填“上等卤水”或“海水”)。
③将“上等卤水”加热蒸发至刚有晶体析出时,所得溶液的组成为:1500g溶液中含水1000g、NaCl398g、MgCl272.5g、其他成分29.5g。
| NaCl、MgCl2的部分溶解度数据 | |||||
| 温度/℃ | 20 | 40 | 60 | 100 | |
| 溶解度(g/100gH2O) | NaCl | 36.0 | 36.6 | 37.3 | 39.8 |
| MgCl2 | 54.3 | 57.5 | 61.3 | 72.5 | |
饱和
饱和
(选填“饱和”或“不饱和”)溶液。Ⅱ、为得到尽可能多且纯度较高的氯化钠晶体,应将1500g此溶液在100℃恒温蒸发
900
900
g水,再 趁热过滤,洗涤烘干
趁热过滤,洗涤烘干
(将操作步骤补充完整)。结合数据分析原因 因为100℃时氯化镁溶解度73g/100g水,72.5g氯化镁就不会析出
因为100℃时氯化镁溶解度73g/100g水,72.5g氯化镁就不会析出
。④如表是某地海水在浓缩过程中析出盐的种类和数量,表中数据为每升海水中析出各盐的质量(单位g/L)。
| 海水密度(g/mL) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.04 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
C
C
。A.1.13~1.21
B.1.21~1.22
C.1.21~1.26
D.1.22~1.31
Ⅱ、关于该海水浓缩过程说法正确的是
B
B
。A.浓缩前该海水的密度等于1.13g/mL
B.海水密度在1.13~1.20g/mL时,密度增大最主要的原因是水分蒸发
C.海水密度在1.22g/mL时氯化钠的溶质质量分数最小
D.海水密度在1.21~1.22g/mL时,溴化钠的溶质质量分数不变
【答案】蒸发;上等卤水;饱和;900;趁热过滤,洗涤烘干;因为100℃时氯化镁溶解度73g/100g水,72.5g氯化镁就不会析出;C;B
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/6 4:0:8组卷:16引用:1难度:0.7
相似题
-
1.闽东的淡水和海水资源丰富
(1)兴趣小组测量集中水样的pH,得到下表数据,其中碱性最强的是(填序号)
(2)山泉水含有较多钙、镁离子,硬度较高水样 来源 pH A 泉水:“海上仙都”-太姥山 6.8~7.0 B 河水:“海国桃园”-杨家溪 7.2~7.6 C 海水:“天然良港”-三都澳 7.8~8.0
①写出钙离子的符号
②若要降低其硬度,可采用的方法是(写一种)
(3)海水是重要资源,处理的大致流程如图: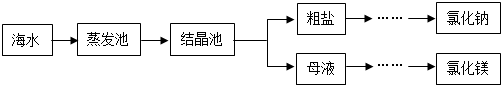
①粗盐经过溶解、过滤、蒸发可除去海沙等不溶性杂质.
a.海沙的主要成分是二氧化硅(SiO2),其中Si的化合价为.
b.若以上操作在实验室中进行,溶解时,玻璃棒的作用是.
②母液经过处理,可得氯化镁,点解熔融氯化镁生成镁和氯气(Cl2).写出电解氯化镁的化学方程式:.发布:2024/12/22 8:0:1组卷:13引用:1难度:0.5 -
2.海洋是人类巨大的资源宝库,其中含有的可溶性物质包括MgCl2等。如图为从海水中提取金属镁的简易流程图。

(1)海洋中含量最多的物质是。
(2)贝壳煅烧的化学方程式是。
(3)操作Ⅰ的名称是,进行该操作时,用到的玻璃仪器有烧杯、玻璃棒和。其中玻璃棒的作用是。
(4)生石灰转化为石灰乳的过程是反应(选填“吸热”或“放热”)。
(5)写出氢氧化镁和盐酸反应的化学方程式。
(6)上述流程中未涉及到的基本反应类型是反应。发布:2024/12/24 12:0:2组卷:221引用:4难度:0.2 -
3.我国的领海主权不容侵犯,南海是我国的固有领海,蕴藏着丰富的海洋资源。
(1)南海不仅蕴含着大量的煤、石油、天然气等常规能源,还蕴藏着大量的可燃冰。可燃冰(主要成分是CH4)被科学家誉为“未来能源”,CH4燃烧的化学方程式,可燃冰作为能源与煤、石油相比的优点是。
(2)南海某岛采用风力发电提供的电能对海水进行了如图1所示的综合利用。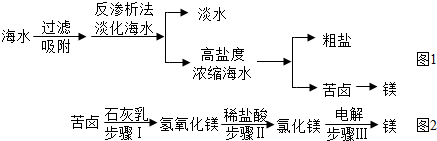
①反渗析法淡化海水是利用海水中各成分的不同分离出淡水。
②将高盐度浓缩海水进行可以分离得到粗盐。
③用苦卤制取金属镁的流程图如图2:
上述转化过程中,所发生的反应属于复分解反应类型的步骤是(填序号),步骤Ⅱ的化学方程式为。利用苦卤制取氢氧化镁比“直接向海水中加入石灰乳制取氢氧化镁”的优势是。
(3)如图3是海水“制碱”的部分简单流程。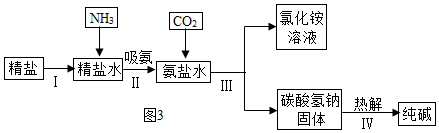
①步骤IⅡ反应的化学方程式为;
②制氨盐水的过程中要先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为;
③氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,首先析出的物质是,原因是,将氯化铵溶液和碳酸氢钠固体分离的方法是过滤,滤液中的溶质有。发布:2024/12/25 12:0:1组卷:85引用:4难度:0.6


