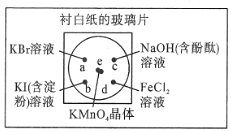
 微型化学实验能有效减少污染,节约药品。图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体
微型化学实验能有效减少污染,节约药品。图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体
(1)①写出化学实验室中用MnO2制取Cl2的化学方程式MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2OMnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O。
②完成本实验中制取Cl2的化学方程式:
22KMnO4+1616HCl(浓)-22KCl+22MnCl2+55Cl2↑+88H2OH2O。
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为8mol8mol。
(2)b处的实验现象为溶液由无色变蓝色溶液由无色变蓝色。c处的实验现象为溶液红色褪去溶液红色褪去。
(3)d处反应的离子方程式为2Fe2++Cl2=2Fe3++Cl-2Fe2++Cl2=2Fe3++Cl-、Fe3++3SCN-=Fe(SCN)3Fe3++3SCN-=Fe(SCN)3。
(4)通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3KMnO4>Cl2>FeCl3。
△
△
【考点】氧化性、还原性强弱的比较.
【答案】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;2;16;2;2;5;8;H2O;8mol;溶液由无色变蓝色;溶液红色褪去;2Fe2++Cl2=2Fe3++Cl-;Fe3++3SCN-=Fe(SCN)3;KMnO4>Cl2>FeCl3
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/25 8:0:9组卷:63引用:3难度:0.7
相似题
-
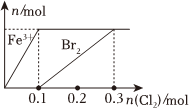 1.向200mLFeBr2溶液中逐渐通入Cl2,其中n(Fe3+)、n(Br2 )随通入n(Cl2)的变化如图所示,下列说法错误的是( )发布:2024/12/7 9:30:1组卷:50引用:3难度:0.5
1.向200mLFeBr2溶液中逐渐通入Cl2,其中n(Fe3+)、n(Br2 )随通入n(Cl2)的变化如图所示,下列说法错误的是( )发布:2024/12/7 9:30:1组卷:50引用:3难度:0.5 -
2.根据反应式:①2Fe3++2I-═2Fe2++I2,②Br2+2Fe2+═2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是( )
发布:2024/11/28 12:30:2组卷:346引用:8难度:0.8 -
3.已知:
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2。
则下列判断正确的是( )发布:2024/12/11 14:0:2组卷:421引用:7难度:0.4


