当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用CO2、H2为原料合成甲醇(CH3OH)过程主要涉及以下反应:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ•mol-1
反应Ⅲ:12CO(g)+H2(g)⇌2CH3OH(g) ΔH3=-45.1kJ•mol-1
(1)根据盖斯定律,反应Ⅰ的ΔH1= -49.0kJ/mol-49.0kJ/mol。
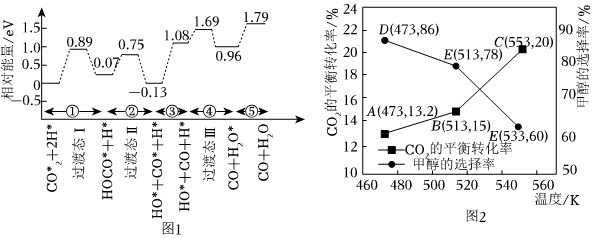
(2)我国学者结合实验与计算机模拟结果,研究了CO2与H2在TiO2/Cu催化剂表面生成CH3OH和H2O的部分反应历程,如图1所示,其中吸附在催化剂表面的物种用*标注。
反应历程中反应速率最快一步的能垒(活化能)的E正= 0.610.61eV。并写出该历程的化学方程式 HOCO*+H*=CO*+H*+OH*ΔH=+0.20 (ev)HOCO*+H*=CO*+H*+OH*ΔH=+0.20 (ev)。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有 ACAC(填字母)。
A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动
B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热
C.增大H2的浓度,有利于提高CO2的平衡转化率
D.及时分离出CH3OH,可以使得反应Ⅰ的正反应速率增大
(4)加压,甲醇产率将 升高升高(填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将 升高升高(填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol CO2和3mol H2在1L密闭容器中只发生反应Ⅰ、Ⅱ,CO2平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的CO2物质的量分数)与温度的变化趋势如图2所示。
①由图可知,达到平衡时,最适宜的反应温度是 513K513K(填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的Kp= 0.123.76P×0.23.76P0.83.76P×(2.563.76P)30.123.76P×0.23.76P0.83.76P×(2.563.76P)3(列出计算式)。(Kp为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
1
2
0
.
12
3
.
76
P
×
0
.
2
3
.
76
P
0
.
8
3
.
76
P
×
(
2
.
56
3
.
76
P
)
3
0
.
12
3
.
76
P
×
0
.
2
3
.
76
P
0
.
8
3
.
76
P
×
(
2
.
56
3
.
76
P
)
3
【答案】-49.0kJ/mol;0.61;HOCO*+H*=CO*+H*+OH*ΔH=+0.20 (ev);AC;升高;升高;513K;
0
.
12
3
.
76
P
×
0
.
2
3
.
76
P
0
.
8
3
.
76
P
×
(
2
.
56
3
.
76
P
)
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/20 5:0:9组卷:20引用:1难度:0.6
相似题
-
1.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
2.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。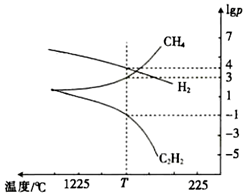
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


