黄铜是铜锌合金,可用于制造钱币、机器零件等。利用黄铜制造各种物品的过程中,会产生大量的黄铜渣,主要含有Zn、Cu、ZnO、CuO。一种利用黄铜渣获取金属铜和硫酸锌溶液的实验流程如图所示。请回答下列问题。
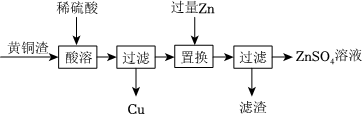
(1)下列说法正确的是 cc。(填字母序号)
a.黄铜不能被腐蚀
b.黄铜的硬度比铜小
c.黄铜的熔点比锌低
(2)“酸溶”过程中有气体生成,发生反应的化学方程式为 Zn+H2SO4=ZnSO4+H2↑Zn+H2SO4=ZnSO4+H2↑。
(3)“置换”过程中需要加入过量Zn的目的是 使硫酸铜完全反应使硫酸铜完全反应。
(4)为进一步提高原料利用率,得到更多的铜和硫酸锌溶液,需要对流程中的“滤渣”进行处理,向滤渣中缓慢加入 稀硫酸稀硫酸(选填“稀硫酸”或“稀盐酸”)并不断搅拌,观察到 无气泡冒出无气泡冒出时停止加入,过滤。
(5)上述流程中,能判断锌的金属活动性比铜强的事实是 “酸溶”过程中Zn能与稀H2SO4反应,而Cu不能反应或(“置换”过程中锌能置换出硫酸铜溶液中的铜)“酸溶”过程中Zn能与稀H2SO4反应,而Cu不能反应或(“置换”过程中锌能置换出硫酸铜溶液中的铜)。(任写一条)
【答案】c;Zn+H2SO4=ZnSO4+H2↑;使硫酸铜完全反应;稀硫酸;无气泡冒出;“酸溶”过程中Zn能与稀H2SO4反应,而Cu不能反应或(“置换”过程中锌能置换出硫酸铜溶液中的铜)
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/1 8:0:9组卷:42引用:3难度:0.5
相似题
-
1.新冠肺炎疫情防控期间,西安市各学校开展全域喷洒低浓度、有效成分是次氯酸钠的“84”消毒液进行消毒。如图所示是模拟制备“84”消毒液的流程(Cl2是一种黄绿色的有毒气体)。请回答下列问题:
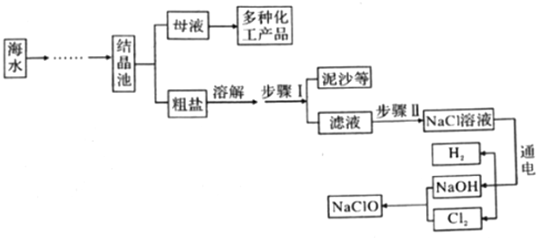
(1)NaOH的俗称为(写一种)。
(2)步骤Ⅱ中,通常用碳酸钠溶液除去滤液中的氯化钙杂质,请写出有关反应的化学方程式。
(3)电解水时,一般在水中加入少量NaOH以增强水的导电性,不能加入NaCl的原因是。发布:2025/1/3 8:0:1组卷:6引用:1难度:0.5 -
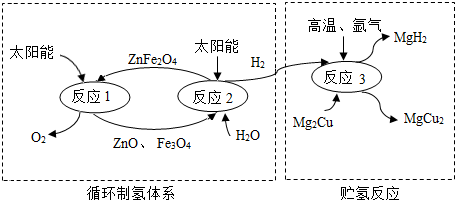 2.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5
2.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5 -
3.某种家用的消毒液的主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,下列说法错误的是( )
发布:2025/1/3 8:0:1组卷:71引用:1难度:0.7


