过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。
(1)试判断,[Mn(H2O)6]2+有有(填“有”或“无”)颜色。
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4) 3-n2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 DD(填序号)。并解释不正确的原因 Mn2+的价电子排布为3d5半满的稳定结构,再失去一个电子需要的能量高,所以Fe2+再失去一个电子比Mn2+容易Mn2+的价电子排布为3d5半满的稳定结构,再失去一个电子需要的能量高,所以Fe2+再失去一个电子比Mn2+容易。
A.PFS中铁显+3价
B.铁原子的外围电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
3
-
n
2
| 元素 | Mn | Fe | |
| 电离能/(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
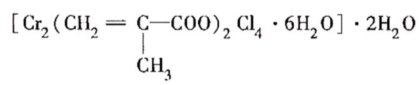
①该化合物中一个Cr的配位数为
6
6
。②甲基丙烯酸分子中C原子的杂化方式为
sp3和sp2
sp3和sp2
。③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是
H2S、
NH
-
2
H2S、
(填两种分子、离子各一种)。NH
-
2
【答案】有;D;Mn2+的价电子排布为3d5半满的稳定结构,再失去一个电子需要的能量高,所以Fe2+再失去一个电子比Mn2+容易;6;sp3和sp2;H2S、
NH
-
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/4 8:0:9组卷:34引用:1难度:0.2
相似题
-
1.在液氨中投入金属钠,迅速溶剂化得到蓝色电子液[Na+(NH3)x和e-(NH3)y]且过程中有少量H2产生。下列说法正确的是( )
发布:2025/1/4 8:0:1组卷:22引用:3难度:0.6 -
2.ZnSO4溶于氨水形成[Zn(NH3)4]SO4,其中配离子[Zn(NH3)4]2+的立体构型为正四面体形。下列说法正确的是( )
发布:2025/1/5 8:0:1组卷:58引用:1难度:0.5 -
3.Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)Pt(NH3 )2 Cl2是平面正方形结构,还是四面体结构.
(2)请画出这两种固体分子的几何构型图,淡黄色固体:. 黄绿色固体:.
(3)淡黄色固体物质是由分子组成,黄绿色固体物质是由分子组成(填“极性分子”或“非极性分子”)发布:2024/12/30 17:0:2组卷:75引用:3难度:0.1


