晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如图:

石英砂的主要成分是SiO2在制备粗硅时,焦炭的作用是还原剂还原剂(填“氧化剂“或“还原剂“):在该反应中,若消耗了3.0gSiO2,则转移电子的总数为1.204×10231.204×1023。
(2)某实验室利用SiHCl3(沸点33.0℃)与过量H2在1000℃~l100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。 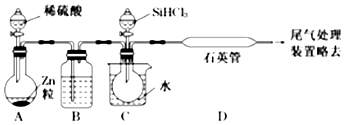
①装置B中的试剂是浓硫酸浓硫酸。装置C中的烧瓶需要加热。其目的是使SiHCl3气化,与氢气反应使SiHCl3气化,与氢气反应。
②反应一段时间后,装置D中观察到的现象是有固体物质生成有固体物质生成;装置D中发生反应的化学方程式为SiHCl3+H2 高温 Si+3HClSiHCl3+H2 高温 Si+3HCl。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有bdbd(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
高温
高温
【答案】还原剂;1.204×1023;浓硫酸;使SiHCl3气化,与氢气反应;有固体物质生成;SiHCl3+H2 Si+3HCl;bd
高温
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/30 4:0:1组卷:193引用:4难度:0.5


