铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(1)人类冶炼和使用金属铝的时间较晚,可能是因为bb(填字母)。
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和硬度大硬度大(写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式:3Li2O+2Al 高温 6Li+Al2O33Li2O+2Al 高温 6Li+Al2O3。
(3)用砂纸去除铝片表面的氧化膜。将其浸入硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。
①写出生成红色物质的化学方程式:2Al+3CuSO4═Al2(SO4)3+3Cu2Al+3CuSO4═Al2(SO4)3+3Cu。
②硫酸铜溶液中的阳离子有H+、Cu2+H+、Cu2+(填离子符号)。
(4)原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由13个铝原子构成,其最外层电子数的总和为40时相对稳定。写出该稳定铝原子簇的微粒符号:Al13-Al13-。
[铝原子的结构示意图为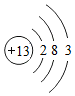 ]
]
高温
高温
【答案】b;硬度大;3Li2O+2Al 6Li+Al2O3;2Al+3CuSO4═Al2(SO4)3+3Cu;H+、Cu2+;Al13-
高温
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/29 1:0:9组卷:484引用:6难度:0.5


