海洋中蕴含丰富的资源。
(1)海水淡化
①海水淡化是解决淡水资源不足的重要方法,下列方法中,可以使海水淡化的是 DD(填字母序号);
A.过滤
B.吸附
C.沉降
D.蒸馏
②用化学方法区分蒸馏水和海水可采用的试剂是 硝酸银溶液硝酸银溶液。
(2)利用海水制取纯碱和金属镁的流程如图所示,试回答问题:
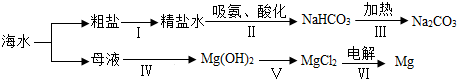
①1925年我国化学家 侯德榜侯德榜创立了联合制碱法,促进了世界制碱技术的发展。
②步骤Ⅰ粗盐形成精盐水的过程中需去除泥沙。除去泥沙需经过溶解、过滤、蒸发三个步骤,均要用到玻璃棒,其中玻璃棒在蒸发中的作用是 搅拌,防止局部温度过高,造成液体飞溅搅拌,防止局部温度过高,造成液体飞溅。
③步骤Ⅰ粗盐形成精盐水的过程中还要除去MgCl2、CaCl2、Na2SO4杂质。可依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,并在滤液中加入适量稀盐酸形成精盐水。加入稀盐酸的目的 除去过量的氢氧化钠和碳酸钠除去过量的氢氧化钠和碳酸钠。
④步骤Ⅱ中吸氨的目的是 使溶液显碱性,更易吸收二氧化碳使溶液显碱性,更易吸收二氧化碳。
⑤其第Ⅲ步反应的化学方程式为 2NaHCO3 △ Na2CO3+H2O+CO2↑2NaHCO3 △ Na2CO3+H2O+CO2↑。
⑥在工业生产中为了减低成本,步骤Ⅳ中所加试剂最好选择的是 氢氧化钙氢氧化钙。
⑦步骤第Ⅵ步反应的化学方程式为 MgCl2通电 Mg+Cl2↑MgCl2通电 Mg+Cl2↑。
2
N
a
HC
O
3
△
N
a
2
C
O
3
+
H
2
O
+
C
O
2
↑
2
N
a
HC
O
3
△
N
a
2
C
O
3
+
H
2
O
+
C
O
2
↑
M
g
C
l
2
通电
M
g
+
C
l
2
↑
M
g
C
l
2
通电
M
g
+
C
l
2
↑
【答案】D;硝酸银溶液;侯德榜;搅拌,防止局部温度过高,造成液体飞溅;除去过量的氢氧化钠和碳酸钠;使溶液显碱性,更易吸收二氧化碳; ;氢氧化钙;
2
N
a
HC
O
3
△
N
a
2
C
O
3
+
H
2
O
+
C
O
2
↑
M
g
C
l
2
通电
M
g
+
C
l
2
↑
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/15 14:0:1组卷:32引用:1难度:0.5
相似题
-
1.海洋是人类巨大的资源宝库,其中含有的可溶性物质包括MgCl2等。如图为从海水中提取金属镁的简易流程图。

(1)海洋中含量最多的物质是。
(2)贝壳煅烧的化学方程式是。
(3)操作Ⅰ的名称是,进行该操作时,用到的玻璃仪器有烧杯、玻璃棒和。其中玻璃棒的作用是。
(4)生石灰转化为石灰乳的过程是反应(选填“吸热”或“放热”)。
(5)写出氢氧化镁和盐酸反应的化学方程式。
(6)上述流程中未涉及到的基本反应类型是反应。发布:2024/12/24 12:0:2组卷:221引用:4难度:0.2 -
2.我国的领海主权不容侵犯,南海是我国的固有领海,蕴藏着丰富的海洋资源。
(1)南海不仅蕴含着大量的煤、石油、天然气等常规能源,还蕴藏着大量的可燃冰。可燃冰(主要成分是CH4)被科学家誉为“未来能源”,CH4燃烧的化学方程式,可燃冰作为能源与煤、石油相比的优点是。
(2)南海某岛采用风力发电提供的电能对海水进行了如图1所示的综合利用。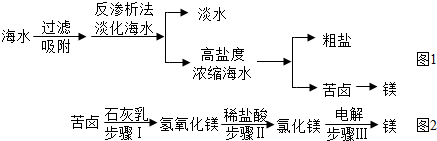
①反渗析法淡化海水是利用海水中各成分的不同分离出淡水。
②将高盐度浓缩海水进行可以分离得到粗盐。
③用苦卤制取金属镁的流程图如图2:
上述转化过程中,所发生的反应属于复分解反应类型的步骤是(填序号),步骤Ⅱ的化学方程式为。利用苦卤制取氢氧化镁比“直接向海水中加入石灰乳制取氢氧化镁”的优势是。
(3)如图3是海水“制碱”的部分简单流程。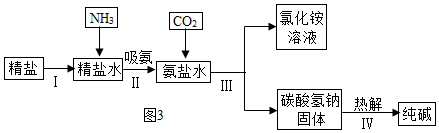
①步骤IⅡ反应的化学方程式为;
②制氨盐水的过程中要先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为;
③氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,首先析出的物质是,原因是,将氯化铵溶液和碳酸氢钠固体分离的方法是过滤,滤液中的溶质有。发布:2024/12/25 12:0:1组卷:85引用:4难度:0.6 -
3.闽东的淡水和海水资源丰富
(1)兴趣小组测量集中水样的pH,得到下表数据,其中碱性最强的是(填序号)
(2)山泉水含有较多钙、镁离子,硬度较高水样 来源 pH A 泉水:“海上仙都”-太姥山 6.8~7.0 B 河水:“海国桃园”-杨家溪 7.2~7.6 C 海水:“天然良港”-三都澳 7.8~8.0
①写出钙离子的符号
②若要降低其硬度,可采用的方法是(写一种)
(3)海水是重要资源,处理的大致流程如图: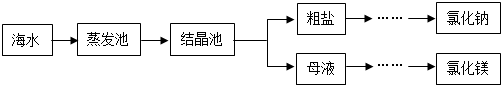
①粗盐经过溶解、过滤、蒸发可除去海沙等不溶性杂质.
a.海沙的主要成分是二氧化硅(SiO2),其中Si的化合价为.
b.若以上操作在实验室中进行,溶解时,玻璃棒的作用是.
②母液经过处理,可得氯化镁,点解熔融氯化镁生成镁和氯气(Cl2).写出电解氯化镁的化学方程式:.发布:2024/12/22 8:0:1组卷:13引用:1难度:0.5


