重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有广泛应用。
(1)实验室可用Cr2O3和KClO3制备重铬酸钾,具体步骤如下:
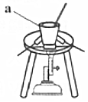
①取过量Na2CO3粉末放入右图所示装置中,加热至融化。图中仪器a的名称是坩埚坩埚。
②称取一定质量的CrO3和KClO3固体,研磨后加入到熔融的Na2CO3中,灼烧35mn后得到含铬酸钠(Na2CrO4)的固体及一种常见无色气态化合物。该反应的化学方程式为CrO3+KClO3+2Na2CO3 高温 2Na2CrO4+KCl+CO2↑CrO3+KClO3+2Na2CO3 高温 2Na2CrO4+KCl+CO2↑。
③取出反应后的固体,加入少量水,加热至沸腾,稍冷后过滤,将所得滤液倒入蒸发皿中,加入3mol•L-1H2SO4溶液至pH<5.写出用pH试纸测溶液pH的操作用洁净的玻璃棒蘸取待测液点滴于试纸的中部,半分钟内与标准比色卡对比用洁净的玻璃棒蘸取待测液点滴于试纸的中部,半分钟内与标准比色卡对比。
④再加入适量氯化钾,发生反应Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。
⑤加热蒸发、冷却结晶、过滤、洗涤、干燥,得到重铬酸钾晶体。
(2)工业上也可用电解铬酸钾的方法制备重铬酸钾(2CrO42-+2H+⇌Cr2O72-+H2O),电极为钛基复合电极,反应原理如图所示。
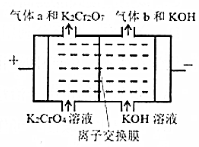
①写出阳极的电极反应式2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O或4CrO42--=2Cr2O72-+O2↑2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O或4CrO42--=2Cr2O72-+O2↑。
②该电解池中应选择阳阳(填“阴”或“阳”)离子交换膜。
(3)已知:固体Cr2O3灼热时呈棕色,冷却后为绿色,不溶于水,也不溶于酸。铬酸银为砖红色固体,难溶于水。选用下列试剂及用品设计实验方案检验重铬酸钾的热分解产物(4K2Cr2O7 高温 4K3CrO4+3O2↑+2Cr2O3)
试剂及用品:盐酸、AgNO3溶液、酒精灯、木条
高温
高温
高温
| 实验步骤 | 现象 |
| ①取重铬酸钾晶体于硬质玻璃管中,用酒精喷灯加热 | ②固体逐渐变成棕色 |
| ③用排水集气法收集产生的无色气体, 将带火星的木条伸入集气瓶 将带火星的木条伸入集气瓶 |
④ 木条复燃 木条复燃 |
| ⑤取冷却后的固体, 加水溶解、过滤,取滤液,滴加少量AgNO3溶液 加水溶解、过滤,取滤液,滴加少量AgNO3溶液 |
⑥产生砖红色沉淀 |
【答案】坩埚;CrO3+KClO3+2Na2CO3 2Na2CrO4+KCl+CO2↑;用洁净的玻璃棒蘸取待测液点滴于试纸的中部,半分钟内与标准比色卡对比;2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O或4CrO42--=2Cr2O72-+O2↑;阳;将带火星的木条伸入集气瓶;木条复燃;加水溶解、过滤,取滤液,滴加少量AgNO3溶液
高温
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/13 16:0:8组卷:24引用:3难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
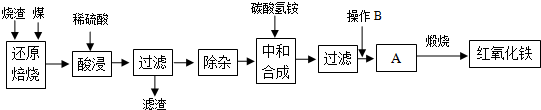
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
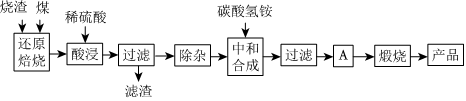
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
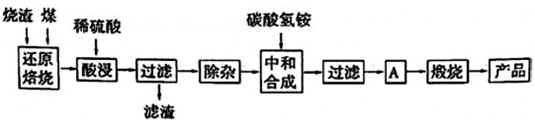
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5


