工业尾气中的氮氧化物是造成大气污染的主要污染源之一。常用的处理方法有选择性催化还原法、氧化吸收法和液相络合还原法等。
(1)NH3在固态FeTiOx表面还原NO的机理如图所示。
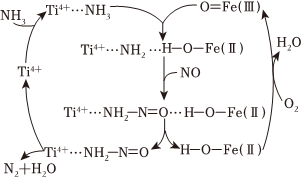
①理论上处理1molNO同时消耗O2的物质的量为 0.25mol0.25mol。
②若工业尾气中同时含SO2,将会使NO的去除率下降,可能的原因是 SO2、O2可与NH3形成(NH4)2SO4[或(NH4)2SO3],覆盖在催化剂表面;SO2还可还原O=Fe(Ⅲ),使催化剂活性降低,NO脱除率下降SO2、O2可与NH3形成(NH4)2SO4[或(NH4)2SO3],覆盖在催化剂表面;SO2还可还原O=Fe(Ⅲ),使催化剂活性降低,NO脱除率下降。
(2)ClO2氧化吸收法。将含NO尾气通入ClO2溶液中,ClO2能将NO氧化为NO2,NO2溶于水反应生成HNO2和HNO3。研究发现,吸收后尾气无NO,但随着ClO2浓度增大吸收后尾气中NO2增多。可能原因是ClO2降低了NO2在水中的溶解度,请设计实验进行验证 相同温度下,用同体积的ClO2水溶液和水作吸收液,将相同体积的NO2用相同速率分别通入吸收液,检验吸收后气体中NO2的量相同温度下,用同体积的ClO2水溶液和水作吸收液,将相同体积的NO2用相同速率分别通入吸收液,检验吸收后气体中NO2的量。
(3)液相络合还原法。Fe(Ⅱ)EDTA溶液将尾气中的NO快速络合生成Fe(Ⅱ)EDTA(NO),再用尿素(或铁碳混合物)将络合的NO还原。
①pH=7时,尿素将NO还原为N2的化学方程式为 2CO(NH2)2+6NO═2CO2+5N2+4H2O2CO(NH2)2+6NO═2CO2+5N2+4H2O。
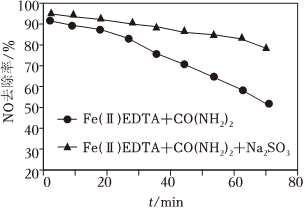
②若向“Fe(Ⅱ)EDTA+CO(NH2)2”体系中添加Na2SO3,该条件下Na2SO3对NO无还原能力,但NO的脱除率变化如图所示。添加Na2SO3能使NO脱除率增大的原因是 Na2SO3可防止将Fe(Ⅱ)EDTA氧化为Fe(Ⅱ)EDTANa2SO3可防止将Fe(Ⅱ)EDTA氧化为Fe(Ⅱ)EDTA。
【考点】氮的氧化物的性质及其对环境的影响.
【答案】0.25mol;SO2、O2可与NH3形成(NH4)2SO4[或(NH4)2SO3],覆盖在催化剂表面;SO2还可还原O=Fe(Ⅲ),使催化剂活性降低,NO脱除率下降;相同温度下,用同体积的ClO2水溶液和水作吸收液,将相同体积的NO2用相同速率分别通入吸收液,检验吸收后气体中NO2的量;2CO(NH2)2+6NO═2CO2+5N2+4H2O;Na2SO3可防止将Fe(Ⅱ)EDTA氧化为Fe(Ⅱ)EDTA
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/8 8:0:10组卷:40引用:1难度:0.5
相似题
-
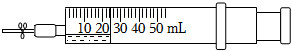 1.如图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口。
1.如图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口。
(1)根据操作步骤,完成表格:
(2)如果要将注射器中的NO充分转化,可以采取什么措施?操作步骤河 实验现象 解释原因 Ⅰ.振荡注射器,观察现象 无明显现象 ① Ⅱ.打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察现象 ② ③ Ⅲ.振荡注射器,再观察现象 气体又变为无色,注射器的活塞向内移动 ④ 。
(3)上述实验对工业上生产硝酸有什么启示?。发布:2024/12/30 6:30:2组卷:9引用:3难度:0.6 -
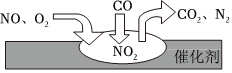 2.随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )发布:2024/12/30 6:30:2组卷:9引用:2难度:0.6
2.随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )发布:2024/12/30 6:30:2组卷:9引用:2难度:0.6 -
3.下列有关NO2的叙述正确的是( )
发布:2024/12/30 6:30:2组卷:7引用:2难度:0.7


