用下列装置测定空气中氧气的体积分数。
【实验一】拉瓦锡用定量的方法研究空气的成分(如图1)该实验中选用汞的优点是 BB。
A.实验过程中没有污染
B.能将密闭装置内空气中的氧气几乎耗尽
C.实验仪器易得到
D.反应不需要条件
【实验二】用红磷测定空气中的氧气含量(如图2)。

①红磷燃烧的文字或符号表达式 红磷+氧气点燃五氧化二磷或P+O2点燃P2O5红磷+氧气点燃五氧化二磷或P+O2点燃P2O5。该实验得到的主要结论是:空气中氧气的体积分数约为五分之一空气中氧气的体积分数约为五分之一。该实验中不能用碳代替红磷得的原因是 碳燃烧生成二氧化碳,导致水不能进入集气瓶,不能测定氧气含量碳燃烧生成二氧化碳,导致水不能进入集气瓶,不能测定氧气含量。
②若实验前未关闭弹簧夹,实验过程中除了看到红磷燃烧可能会出现哪些现象 量筒内的导管口有气泡产生量筒内的导管口有气泡产生。(答一点即可)
【实验三】为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师利用传感器技术实时测定了实验装置(如图3)内的气体压强、温度和氧气浓度,它们随时间的变化曲线如图4所示。
①其中Y表示的是 氧气浓度氧气浓度变化的曲线。
②结合X、Y两条曲线,分析图3中BC段压强增大的原因 温度升高所增加的气压大于氧气消耗所减小的气压温度升高所增加的气压大于氧气消耗所减小的气压。
③实验中测得氧气的含量小于理论值的原因可能是 氧气未完全消耗氧气未完全消耗。
【实验四】实验资料表明,当氧气的体积分数低于7%时红磷就无法继续燃烧,因此通过上述实验测得结果与理论值误差较大。继续对实验进行改进。
【在阅资料】四硫化钠(Na2S4)水溶液能与氧气发生反应:Na2S4+O2+2H2O═8S↓+4NaOH
【实验过程】用图5所示的装置进行实验,测量试管塞紧橡皮塞后容积为50mL;检验气密性后,关闭止水夹,打开橡皮塞,向试管中加入足量的四硫化钠,再向试管中加水形成10mL溶液,迅速塞紧橡皮塞,充分振荡试管。
①打开止水夹,理论上倒吸入试管的体积约为 88mL。
②改进后的实验比实验二测量结果更准确的原因是(答一点即可) 四硫化钠水溶液能与氧气完全反应四硫化钠水溶液能与氧气完全反应。
点燃
点燃
点燃
点燃
【考点】测定空气里氧气含量的探究.
【答案】B;红磷+氧气五氧化二磷或P+O2P2O5;空气中氧气的体积分数约为五分之一;碳燃烧生成二氧化碳,导致水不能进入集气瓶,不能测定氧气含量;量筒内的导管口有气泡产生;氧气浓度;温度升高所增加的气压大于氧气消耗所减小的气压;氧气未完全消耗;8;四硫化钠水溶液能与氧气完全反应
点燃
点燃
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/2 5:0:8组卷:18引用:1难度:0.5
相似题
-
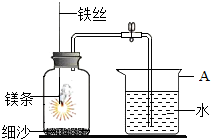 1.某校研究性学习小组用如图所示装置进行镁条在空气中燃烧的实验。待镁条完全燃烧并冷却后打开弹簧夹,进入集气瓶中水的体积约占集气瓶容积的70%。
1.某校研究性学习小组用如图所示装置进行镁条在空气中燃烧的实验。待镁条完全燃烧并冷却后打开弹簧夹,进入集气瓶中水的体积约占集气瓶容积的70%。
(1)图中A仪器的名称是。镁条燃烧并冷却后打开弹簧夹,水能进入到集气瓶中的原因是。
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的%.现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
【发现问题】氮气是如何减少的?
【做出猜想】。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。氮化化镁中氮的化合价是。镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁,反应的化学方程式为2Mg+CO2C+2MgO,该反应所的基本反应类型是点燃。
(3)通过以上探究,你对燃烧的有关知识有了哪些新的认识?(写出一条即可)
(4)24g镁在二氧化碳中燃烧可生成多少克氧化镁?发布:2024/11/18 8:0:1组卷:13引用:1难度:0.5 -
2.如图1是某化学兴趣小组利用气压传感器测定红磷燃烧时集气瓶内气压变化的实验装置。图2是集气瓶内气压随时间的变化情况。下列说法不正确的是( )
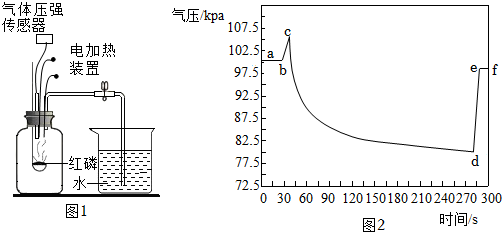 发布:2024/12/25 11:30:2组卷:1085引用:3难度:0.7
发布:2024/12/25 11:30:2组卷:1085引用:3难度:0.7 -
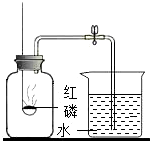 3.测定空气里氧气的含量,甲、乙、丙三个同学用如图所示的装置分别进行了实验探究。
3.测定空气里氧气的含量,甲、乙、丙三个同学用如图所示的装置分别进行了实验探究。
(1)实验时,取下橡胶塞,点燃红磷后迅速伸入集气瓶中并旋紧橡胶塞,这时看到的现象是,该反应的文字表达式为。
(2)甲同学:用足量的木炭代替红磷做测定空气中氧气含量的实验,结果实验失败了,请你帮助他分析失败的原因:。
(3)乙同学:想用镁条来代替红磷做实验,老师告诉他这种方法不是较好的方法,因为镁条在空气中燃烧非常剧烈,镁既可以和氧气反应,也可以和氮气反应生成氮化镁。请写出镁和氮气反应生成氮化镁的文字表达式:。
(4)丙同学:打算用铁丝替代红磷,实验能否成功?请说明理由。。
(5)燃烧后,集气瓶内剩余的气体主要是氮气,请结合本实验推测氮气的物理性质是。发布:2024/11/7 8:0:2组卷:19引用:1难度:0.5


