弱电解质在水溶液中会部分电离产生阴、阳离子,部分盐在水溶液中会发生水解,难溶电解质能与水溶液中的离子建立沉淀溶解平衡。利用以上化学反应原理解释生活生产中的相关问题:
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量CaSO4可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因 CO2-3+CaSO4=SO2-4+CaCO3CO2-3+CaSO4=SO2-4+CaCO3。
(2)酸碱中和滴定法在工农业生产和医药卫生等方而都有非常重要的作用。室温下用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:
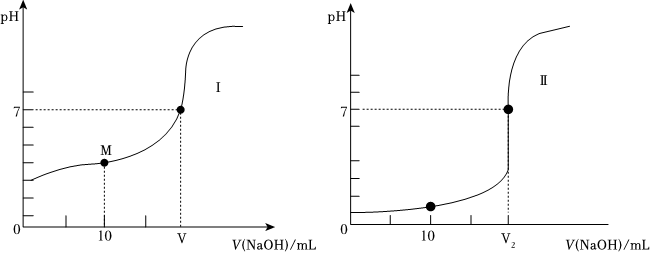
①滴定前的上述三种溶液中,由水电离出的c(H+)最大的是 CH3COOHCH3COOH溶液(填化学式)。
②上述滴定曲线图为滴定醋酸溶液的是 ⅠⅠ(填“Ⅰ”或“Ⅱ”);用酚酞作指示剂,判断到达滴定终点的操作及现象 溶液的颜色由无色逐渐变化为红色,且半分钟内不褪色溶液的颜色由无色逐渐变化为红色,且半分钟内不褪色。
③图中M点溶液的离子浓度由大到小顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
(3)三氯化铁是一种重要的化合物,可用来腐蚀电路板。某温度下,腐蚀废液含有0.5mol/LFe3+和0.26mol/LCu2+,使Fe3+完全沉淀[c(Fe3+)<1.0×10-5mol/L认为沉淀完全],而Cu2+不沉淀,则需控制溶液pH的范围为 3≤pH<53≤pH<5。{某温度时,Ksp[Cu(OH)2]=2.6×10-19;Ksp[Fe(OH)3]=1.0×10-38}
CO
2
-
3
SO
2
-
4
CO
2
-
3
SO
2
-
4
【答案】+CaSO4=+CaCO3;CH3COOH;Ⅰ;溶液的颜色由无色逐渐变化为红色,且半分钟内不褪色;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);3≤pH<5
CO
2
-
3
SO
2
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/18 0:0:8组卷:31引用:3难度:0.6


