用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11克食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100克溶液,取120克氯化钙溶液平均分6次加入食用碱溶液中,充分反应后实验数据如下表。
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 |
| 加入CaCl2溶液的质量/克 | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
| 生成沉淀的总质量/克 | 2.0 | 4.0 | 8.0 | 10.0 | 10.0 |
(1)第3次加入20.0克CaCl2溶液充分反应后生成沉淀总质量为
6.0
6.0
克。(2)依据实验数据可知,要使11克食用碱样品中的碳酸钠恰好完全反应需要CaCl2溶液的总质量
100.0
100.0
克。(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
【考点】根据化学反应方程式的计算.
【答案】6.0;100.0
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/9 8:0:9组卷:19引用:1难度:0.5
相似题
-
 1.绍兴盛产一种四角菱,称“驮背白”。其菱肉富含淀粉等多种营养物质,此外菱角的茎和根富含纤维素(C6H10O5)n,也是一种很不错的食物和药材。
1.绍兴盛产一种四角菱,称“驮背白”。其菱肉富含淀粉等多种营养物质,此外菱角的茎和根富含纤维素(C6H10O5)n,也是一种很不错的食物和药材。
(1)菱肉中的钙、磷、铁等元素是以(填“单质”或“化合物”)的形态存在;
(2)该纤维素中C、H、O元素的质量比(最简比);
(3)查阅资料获悉菱肉制成的菱粉质细爽滑,为淀粉中之佳品。求菱叶产生3.6千克淀粉[有机物(CH2O)n]的同时,光合作用产生氧气多少千克?(已知光合作用的化学方程式为:nCO2+nH2O═(CH2O)n+nO2,条件忽略)发布:2025/1/6 8:0:1组卷:4引用:1难度:0.5 -
2.小金为测定某样品中氧化铜的质量分数,称量固体样品20.0克,用如图所示的装置进行实验(杂质不参与反应且生成水完全被吸收),实验中共消耗0.6克氢气,测得B装置反应前后的质量增加了3.6克。
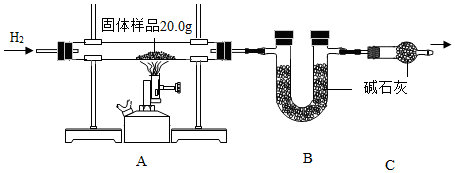
(1)C装置的作用是;
(2)计算固体样品中氧化铜的质量分数(根据化学方程式列式计算)。发布:2024/12/28 15:30:1组卷:12引用:2难度:0.5 -
3.侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下:NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl,请回答:
(1)反应产物中NH4C1可以用于农业生产,它属于化肥中的肥。
(2)生产16.8t碳酸氢钠,理论上需要氯化钠的质量是多少?发布:2024/12/28 15:30:1组卷:12引用:2难度:0.5


