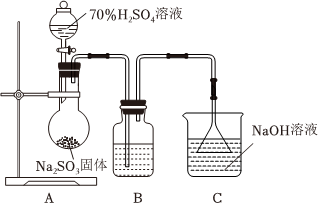
 为探究SO2的性质,采用下列实验装置制少量SO2并进行相应的实验探究:
为探究SO2的性质,采用下列实验装置制少量SO2并进行相应的实验探究:
(1)装置A中制少量SO2反应的方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑。
(2)若B中的试剂是品红溶液,现象是品红溶液褪色,体现SO2的 漂白漂白性。若B中的试剂是酸性KMnO4溶液,写出反应的离子方程式(MnO-4被还原为Mn2+) 5SO2+2MnO-4+2H2O═2Mn2++5SO2-4+4H+,5SO2+2MnO-4+2H2O═2Mn2++5SO2-4+4H+,。
(3)装置C中倒置漏斗的作用是 防止倒吸防止倒吸,反应的离子方程式为 SO2+2OH-=SO2-3+H2OSO2+2OH-=SO2-3+H2O。
M
n
O
-
4
M
n
O
-
4
SO
2
-
4
M
n
O
-
4
SO
2
-
4
SO
2
-
3
SO
2
-
3
【考点】二氧化硫的性质.
【答案】Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;漂白;5SO2+2+2H2O═2Mn2++5+4H+,;防止倒吸;SO2+2OH-=+H2O
M
n
O
-
4
SO
2
-
4
SO
2
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/9 8:0:8组卷:33引用:2难度:0.5


