已知浓盐酸与高锰酸钾固体混合反应能生成Cl2、KCl和MnCl2等,实验小组在实验室设计如图装置制备纯净、干燥的Cl2并检验其性质,请回答:
(1)制备氯气和金属氯化物
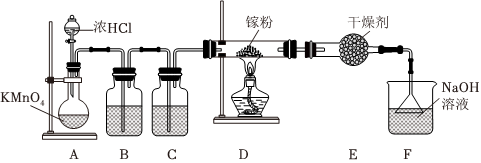
①装置A中发生反应的离子方程式为 10Cl-+16H++2MnO-4=5Cl2↑+8H2O+2Mn2+10Cl-+16H++2MnO-4=5Cl2↑+8H2O+2Mn2+。
②已知镓(Ga)是一种“类铝”金属,能与氯气反应,装置D中反应的生成物为 GaCl3GaCl3(填化学式),该生成物具有很强的吸湿性,在空气中易吸收水蒸气而冒烟。为保证实验顺利进行,装置B、C中盛放的试剂依次为 饱和食盐水饱和食盐水、浓硫酸浓硫酸。装置E的作用是 避免F中的水蒸气进入反应装置避免F中的水蒸气进入反应装置。
(2)检验氯气的性质:
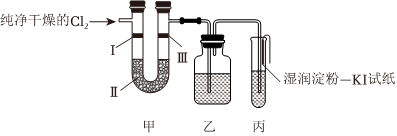
①装置甲的实验目的是验证氯气是否具有漂白性,则甲中Ⅰ、Ⅱ、Ⅲ应依次放 bb(填字母)。
M
n
O
-
4
M
n
O
-
4
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 生石灰 | 湿润的有色布条 |
| b | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
溶液变成橙色
溶液变成橙色
。该现象说明 氯气的氧化性大于溴
氯气的氧化性大于溴
。③装置丙中盛有NaOH溶液,试管口内部放置湿润淀粉-KI试纸的主要目的是
检验是否有氯气泄漏进入空气
检验是否有氯气泄漏进入空气
。【答案】10Cl-+16H++2=5Cl2↑+8H2O+2Mn2+;GaCl3;饱和食盐水;浓硫酸;避免F中的水蒸气进入反应装置;b;溶液变成橙色;氯气的氧化性大于溴;检验是否有氯气泄漏进入空气
M
n
O
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/16 8:0:10组卷:32引用:1难度:0.6
相似题
-
1.为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如图.其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸.干燥红色布条、浓硫酸、湿润红色布条.
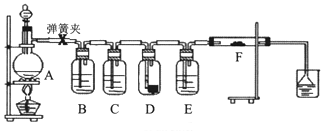
请回答:
(1)E中浓硫酸的作用.
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是.
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有.
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量.发布:2025/1/15 8:0:2组卷:17引用:1难度:0.3 -
2.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
 发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8
发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8 -
3.实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图,下列说法不正确的是( )
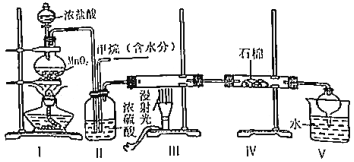 发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7
发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7


