某化学小组制备SO2并验证SO2的部分性质,装置如图所示(部分夹持装置省略):
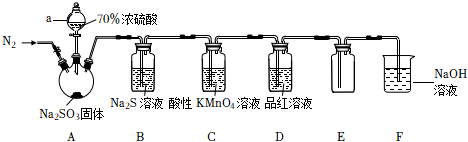
(1)仪器a的名称是 分液漏斗分液漏斗。
(2)装置A制取SO2的反应中,利用了浓硫酸的 强酸强酸性,不能不能(填“能”或“不能”)用浓硝酸代替。
(3)在滴加浓硫酸之前,需先通入一段时间的N2,此操作的目的是 排除空气的干扰排除空气的干扰。
(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为 SO2+2Na2S+2H2O=4NaOH+3S↓SO2+2Na2S+2H2O=4NaOH+3S↓。
(5)装置D验证了SO2的漂白性,为了进一步探究SO2与品红作用的可逆性,请写出有关实验操作及现象:待品红溶液完全褪色后,关闭分液漏斗的旋塞,取D中少量褪色后的液体于试管中,用酒精灯加热,观察到的现象为无色溶液恢复为红色待品红溶液完全褪色后,关闭分液漏斗的旋塞,取D中少量褪色后的液体于试管中,用酒精灯加热,观察到的现象为无色溶液恢复为红色。
(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如图操作:
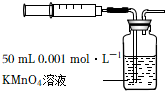
当注入标准状况下10mL混合气体时,酸性KMnO4,溶液恰好褪色,假设混合气体中SO2能被KMnO4溶液充分吸收。已知:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4。该混合气体中二氧化硫的体积分数为 28%28%。
【考点】二氧化硫的性质.
【答案】分液漏斗;强酸;不能;排除空气的干扰;SO2+2Na2S+2H2O=4NaOH+3S↓;待品红溶液完全褪色后,关闭分液漏斗的旋塞,取D中少量褪色后的液体于试管中,用酒精灯加热,观察到的现象为无色溶液恢复为红色;28%
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/24 0:0:8组卷:24引用:3难度:0.6


