钢铁是日常生活中应用最为广泛的金属材料。
工业炼铁的原理是,高温下焦炭在高炉中生成的一氧化碳跟铁矿石反应生成铁。请回答下列问题:
(1)写出防止钢铁锈蚀的一种措施 保持铁制品表面的洁净和干燥保持铁制品表面的洁净和干燥。
(2)加入焦炭,其作用除了可以生成一氧化碳外,还能 提供热源,维持炉温提供热源,维持炉温。
(3)1000t含氧化铁80%的赤铁矿石中,用这些赤铁矿石理论上可以炼出含杂质4%的生铁的质量?(计算结果保留一位小数)。
解:设理论上可炼出含杂质4%的生铁的质量为x。
Fe2O3+3CO高温 2Fe+3CO2 160 112
1000t×80% x×(1-4%)
列出比例式:160112=1000t×80%x×(1-4%)160112=1000t×80%x×(1-4%)
x=583.3t583.3t
答:略。
Ⅱ.某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。所用装置如如图所示。
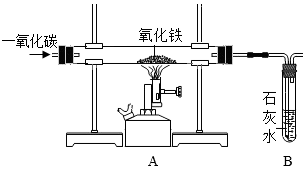
(4)如果实验成功,请回答下列问题:
①实验过程中A中产生的现象 红棕色固体粉末逐渐变成黑色红棕色固体粉末逐渐变成黑色。
②B装置中发生反应的化学方程式 CO2+Ca(OH)2=CaCO3↓+H2OCO2+Ca(OH)2=CaCO3↓+H2O。
③该实验的操作步骤 BADCBADC。(选项不可重复选择)
A.点燃A处酒精喷灯
B.通入CO气体
C.停止通入CO气体
D.熄灭酒精喷灯
④该装置设计有一个明显缺陷,你认为是 没有尾气处理装置没有尾气处理装置。
实验时准确称取一定质量纯净的Fe2O3固体和相关装置的质量按如图进行实验,当固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸发现固体全部溶解,但无气泡产生。实验测得部分数据如下:
| ||
1000 t × 80 % x × ( 1 - 4 % ) |
160
112
1000
t
×
80
%
x
×
(
1
-
4
%
)
160
112
1000
t
×
80
%
x
×
(
1
-
4
%
)
| 玻璃管中固体的质量 | 装置B试管及其中物质的总质量 | |
| 反应前 | 32g | 300g |
| 反应后 | 28.8g | 308g |
①Fe2O3与CO反应的固体生成物可能情况如下:
Fe2O3
400
℃~
500
℃
500
℃~
600
℃
700
℃~
800
℃
②铁的氧化物在足量的稀盐酸中均能全部溶解;③石灰水只能吸收部分CO2
(5)实验结论:根据实验现象判断反应后的黑色固体中是否含有铁
否
否
。(填“是”或“否”)(6)分析推断:装置B试管中增加的质量会小于理论产生的CO2质量,可能原因是
ABD
ABD
。A.未参加反应的CO通过B时带走了水蒸气
B.石灰水浓度小没有将CO2完全吸收
C.石灰水吸收了空气中的CO2
D.产生的CO2中混有少量CO
【答案】保持铁制品表面的洁净和干燥;提供热源,维持炉温;=;583.3t;红棕色固体粉末逐渐变成黑色;CO2+Ca(OH)2=CaCO3↓+H2O;BADC;没有尾气处理装置;否;ABD
160
112
1000
t
×
80
%
x
×
(
1
-
4
%
)
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/4 19:0:2组卷:32引用:1难度:0.5
相似题
-
 1.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
1.家庭厨房就是一个充盈的化学小世界,“柴米油盐酱醋糖”中包含着许多化学内容.
(1)米、面的主要成分都是由三种元素组成的淀粉,淀粉属于糖类.
(2)水瓶内的水垢主要成分是碳酸钙,可用(填一种调味品)除去.
(3)白糖与红糖主要成分都是蔗糖.利用活性炭的性,可将红糖脱色成白糖.
(4)市场上销售的香肠、盐水鸭、榨菜、豆腐干等食品,常采用真空包装,其目的是防止食品而变质.
(5)味精是烹制菜肴时常用的调味品,小明研究某品牌味精包装上的部分文字说明后,想测定此味精中氯化钠的含量.
[查阅资料]NaCl+AgNO3=AgCl↓+NaNO3,谷氨酸钠的存在不影响NaCl性质.
[实验过程]
①称取该味精样品10.0g,并溶于蒸馏水
②加入过量的硝酸银溶液,过滤
③用蒸馏水反复洗涤沉淀多次
④将沉淀烘干、称量,测得固体质量为5.74g
根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器除烧杯、铁架台(带铁圈)、玻璃棒外,还需要的玻璃仪器是.
②试通过计算确定此样品中NaCl质量分数与其包装上标注的含量是否相符.发布:2025/1/6 8:0:1组卷:68引用:2难度:0.5 -
2.化学兴趣小组同学们在老师的指导下对市售某品牌“钙片”的补钙原理、成分以及功效展开了项目化学习的探究。
【查阅资料】
(1)该补钙剂的主要成分有碳酸钙、维生素D3、硫酸锌、水果香料等。
(2)维生素D3、水果香料都不溶于水也不与酸反应,维生素D3主要作用是促进人体对钙的吸收。
项目一:探究“钙片”补钙原理。
【分析交流】
“钙片”中钙以碳酸钙形式存在,“钙片”进入胃首先要通过人体胃酸对其进行溶解后方可被吸收。
【进行实验】
【反思评价】服用“钙片”时,采用实验方案 实验现象 实验结论或化学方程式 取适量“钙片”粉末于试管中,滴加足量 。化学方程式 (填“吞服”或“嚼服”)的服药方式更有利促进胃肠吸收。
项目二:探究“钙片”中是否含有硫酸锌。
项目三:探究“钙片”的功效。实验方案 实验现象 实验结论 另取少量“钙片”粉末于试管中,加足量水,充分溶解,取适量上层清液于试管中,加入几滴 。“钙片”中含有硫酸锌。
【交流讨论】
该补钙剂适用于中老年人治疗因缺钙导致的患者。老师建议大家应注意平时的饮食补钙,牛奶、鱼类等食物除富含营养素外,是较好的补钙食物,应该多食用。发布:2025/1/3 16:0:5组卷:30引用:1难度:0.5 -
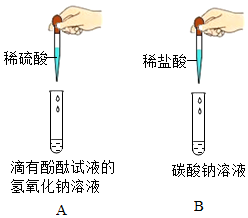 3.酸、碱、盐种类繁多,与人类生活和生产关系密切。请回答下列问题:
3.酸、碱、盐种类繁多,与人类生活和生产关系密切。请回答下列问题:
(1)造纸业会产生大量含NaOH的碱性废水,需经处理至中性排放。
①写出NaOH的俗称:(一个即可)。
②若某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸9.8t(H2SO4的质量分数为10%)。可以处理的废水质量为t。
(2)某化学兴趣小组做了如图所示的两个实验。完成A、B两个实验后,同学们将实验后的废液倾倒入一个废液缸中,发现废液呈红色,小组同学对废液成分展开了如下探究。(该题实验过程中所用溶液浓度较低;氯化钙溶液和氯化钡溶液显中性;实验中如涉及硫酸钙、氢氧化钙等微溶物,均可看做可溶物)
【交流讨论】小组同学经讨论分析后一致认为废液中一定含有的溶质有氯化钠和(酚酞除外)。
【提出猜想】废液中还含有的物质:
猜想一:NaOH;
猜想二:Na2CO3;
猜想三:(填化学式)。
【实验验证】
甲同学取少量废液于试管中,向其中加入过量的氯化钙溶液,通过观察现象,得出了正确结论。若猜想二正确,甲同学观察到的现象:有白色沉淀生成,;请写出发生反应的化学方程式:。
【交流与反思】乙同学认为,将甲同学实验中的氯化钙溶液换成氯化钡溶液,也能得出正确结论。你认为乙同学的观点是否正确并说明你的理由:。发布:2025/1/3 8:0:1组卷:91引用:1难度:0.5


