硼氢化钠(NaBH4)是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析NaBH4纯度的步骤如下,请结合信息回答问题。
| NaBH4 | NaH | CH3ONa | |
| 性质 | 固体,可溶于异丙胺或水,常温下与水缓慢反应,与酸剧烈反应,强碱环境下能稳定存在 | 固体,强还原性,与水剧烈反应产生H2 | 固体,难溶于异丙胺,常温下与水剧烈反应 |
先打开K2,向装置中鼔入N2,然后升温到110℃左右,打开搅拌器快速搅拌,将融化的Na快速分散到石蜡油中,然后升温到200℃,关闭K2,打开K1通入H2,充分反应后制得NaH。然后升温到240℃,持续搅拌下通入N2,打开K3向三颈瓶中滴入硼酸三甲酯[分子式为B(OCH3)3,沸点为68℃],充分反应后,降温后离心分离得到NaBH4和CH3ONa的固体混合物。
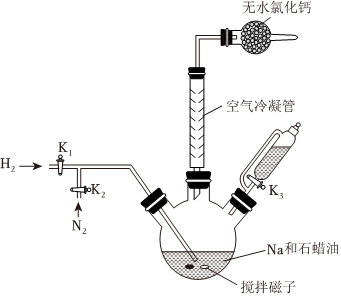
(1)写出NaH与B(OCH3)3的化学反应方程式
4NaH+B(OCH3)3 NaBH4+3CH3ONa
240
℃
4NaH+B(OCH3)3 NaBH4+3CH3ONa
。240
℃
(2)下列说法正确的是
AB
AB
。A.鼓入N2可以防止Na、NaH、NaBH4等被氧化
B.搅拌并将Na分散到石蜡油中可以加快H2与钠的反应速率
C.取200℃时的产物加入水中,观察是否有H2产生,从而判断NaH中是否含有Na
D.快速滴入B(OCH3)3有利于提高其转化率
Ⅱ.NaBH4的提纯
(3)NaBH4可采用索氏提取法提纯,其装置如图所示。实验时将NaBH4和CH3ONa的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点:-101℃,沸点:33℃)受热蒸发,蒸汽沿导管
2
2
(填“2”或“3”)上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管 3
3
(填“2”或“3”)返回烧瓶,从而实现连续萃取。当萃取完全后,NaBH4在 圆底烧瓶
圆底烧瓶
(填“圆底烧瓶”或“索氏提取器”)中。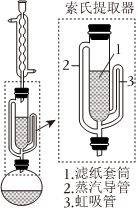
(4)分离异丙胺和NaBH4并回收溶剂的方法是
蒸馏
蒸馏
。Ⅲ.NaBH4的纯度分析
步骤1:取9.00gNaBH4产品(杂质不参与反应),将产品溶于X1溶液后配成200mL溶液,取2.00mL置于碘量瓶中,加入30.00mL0.1000mol⋅L-1KIO3溶液充分反应。(反应为3NaBH4+4KIO3=3NaBO2+4KI+6H2O)
步骤2:向步骤1所得溶液中加入过量的KI溶液,用X2溶液调节pH,使过量KIO3转化为I2,冷却后暗处放置数分钟。
步骤3:向步骤2所得溶液中加缓冲溶液X3调pH约为5.0,加入几滴淀粉指示剂,用0.2000mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的体积为18.00mL。(反应为I2+2Na2S2O3=2NaI+Na2S4O6)
(5)X1溶液为
B
B
,X2溶液为 A
A
,缓冲溶液X3为 D
D
。(填序号)A.稀硫酸
B.NaOH溶汼
C.NH4Cl和NH3⋅H2O混合液
D.CH3COOH和CH3COONa混合液
已知:Ka(CH3COOH)=1.0×10-5,Kb(NH3⋅H2O)=1.0×10-5,两种混合液中溶质物质的量之比均为1:1。
(6)产品中NaBH4的纯度为
76
76
%。滴入Na2S2O3标准溶液时若长时间振荡可能导致测定结果 偏低
偏低
(填“偏高”或“偏低”)。【考点】制备实验方案的设计.
【答案】4NaH+B(OCH3)3 NaBH4+3CH3ONa;AB;2;3;圆底烧瓶;蒸馏;B;A;D;76;偏低
240
℃
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/17 8:0:9组卷:43引用:1难度:0.5
相似题
-
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如图:
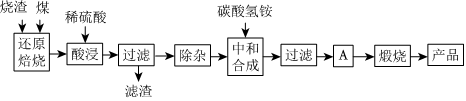
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,检验Fe3+已经除尽的试剂是;当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.
(5)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:114引用:4难度:0.5 -
2.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
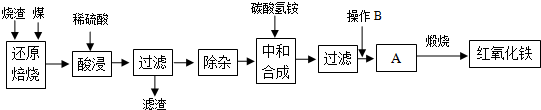
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,检验
Fe3+已经除尽的试剂是.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是.
(5)煅烧A的反应方程式是.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于(用含a、b的表达式表示).发布:2025/1/19 8:0:1组卷:5引用:1难度:0.5 -
3.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
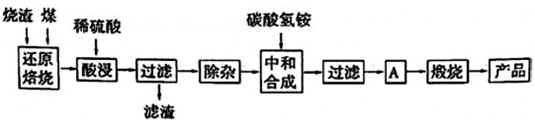
(1)在“还原焙烧”中产生的有毒气体可能有.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于氢氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 开始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常温下,当pH=5时,溶液中c(Al3+)=mol•L-1(已知常温下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是.发布:2025/1/19 8:0:1组卷:12引用:1难度:0.5
相关试卷


