氯化钠是生产、生活中的一种重要化合物,应用很广泛。
(1)加碘食盐中的“碘”指的是 CC。(填字母)
A.碘原子
B.碘分子
C.碘元素
D.碘单质
(2)物质由微观粒子构成。构成NaCl的微粒是Na+和 C1-C1-。
(3)实验室选用下列仪器配制50g质量分数为6%的氯化钠溶液。
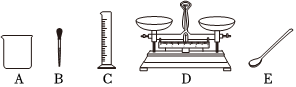
①所需氯化钠固体的质量为 33g。
②完成该实验,图中缺少一种玻璃仪器,请写出该仪器的名称:玻璃棒玻璃棒。
③若配制结果偏小,可能是量取水时 仰视仰视(填“俯视”或“仰视”)量筒读数造成的。
(4)为了除去粗盐中所含有的CaCl2、MgCl2、Na2SO4杂质,某化学小组设计了如下实验步骤:向粗盐中加适量水,将其溶解成粗盐水,再向粗盐水中依次加入过量BaCl2、NaOH、Na2CO3溶液,过滤后向滤液中加入适量稀盐酸,蒸发结晶。
①写出加入Na2CO3时所发生反应的化学方程式:Na2CO3+BaCl2=BaCO3↓+2NaCl或CaCl2+Na2CO3=CaCO3↓+2NaClNa2CO3+BaCl2=BaCO3↓+2NaCl或CaCl2+Na2CO3=CaCO3↓+2NaCl。(写出一个即可)
②请设计实验验证所得滤液中含有的杂质:取少量滤液于试管中,加入足量的氯化钙溶液,有白色沉淀产生,证明含有碳酸钠;静置,向上层清液中滴加酚酞溶液,溶液变红,证明还含有氢氧化钠取少量滤液于试管中,加入足量的氯化钙溶液,有白色沉淀产生,证明含有碳酸钠;静置,向上层清液中滴加酚酞溶液,溶液变红,证明还含有氢氧化钠。(简要叙述实验步骤、现象及结论)
(5)工业上常用电解饱和氯化钠溶液的方法制取氢氧化钠,并得到氯气(Cl2)和一种可燃性气体单质。若要制得80t氢氧化钠,需要氯化钠的质量是多少?
【答案】C;C1-;3;玻璃棒;仰视;Na2CO3+BaCl2=BaCO3↓+2NaCl或CaCl2+Na2CO3=CaCO3↓+2NaCl;取少量滤液于试管中,加入足量的氯化钙溶液,有白色沉淀产生,证明含有碳酸钠;静置,向上层清液中滴加酚酞溶液,溶液变红,证明还含有氢氧化钠
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/25 8:0:9组卷:22引用:3难度:0.5
相似题
-
 1.水是生命之源,扬州是运河之城,也是南水北调的起点.请根据题意回答下列有关水溶液的问题.
1.水是生命之源,扬州是运河之城,也是南水北调的起点.请根据题意回答下列有关水溶液的问题.
(一)将10克NaOH固体完全溶解在40毫升水中(水的密度为1g/cm3),所配溶液中溶质的质量分数为.某同学在配制过程中,量取水时仰视读数(其它操作均正确),其所配氢氧化钠溶液中溶质的质量分数将(填“偏大”或“偏小”).另一位同学称取NaOH时,由于操作不熟练,花了较长时间,那么,他所配氢氧化钠溶液中溶质的质量分数将.(填“偏大”或“偏小”).
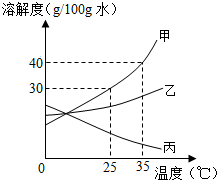
(二)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为g.
(2)要使35℃时接近饱和的甲溶液变成该温度下的饱和溶液,可采用的一种方法是.
(3)现有操作步骤:a.溶解 b.过滤 c.降温结晶 d.加热浓缩.若甲固体中含有少量乙,则提纯甲的操作步骤是(填字母序号).
(4)将35℃时丙的饱和溶液降温到25℃,则其溶液的溶质质量分数(填“变大”、“变小”或“不变”).
(5)向100g35℃的水中加入48g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出.你认为“全部溶解”的原因可能是.发布:2024/12/5 8:0:1组卷:30引用:1难度:0.3 -
2.关于配制50g 8%的氢氧化钠溶液,下列说法正确的是( )
发布:2024/11/14 23:30:4组卷:220引用:10难度:0.6 -
 3.水是生命之源,扬州是运河之城,也是南水北调的起点。请根据题意回答下列有关水溶液的问题。
3.水是生命之源,扬州是运河之城,也是南水北调的起点。请根据题意回答下列有关水溶液的问题。
(一)将10克NaOH固体完全溶解在40毫升水中(水的密度为1g/cm3),所配溶液中溶质的质量分数为。某同学在配制过程中,量取水时仰视读数(其它操作均正确),其所配氢氧化钠溶液中溶质的质量分数将(填“偏大”或“偏小”)。另一位同学称取NaOH时,由于操作不熟练,花了较长时间,那么,他所配氢氧化钠溶液中溶质的质量分数将。(填“偏大”或“偏小”)。
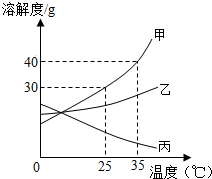
(二)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为g。
(2)要使35℃时接近饱和的甲溶液变成该温度下的饱和溶液,可采用的一种方法是。
(3)现有操作步骤:a.溶解 b.过滤 c.降温结晶 d.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤是(填字母序号)。
(4)将35℃时丙的饱和溶液降温到25℃,则其溶液的溶质质量分数(填“变大”、“变小”或“不变”)。
(5)向100g35℃的水中加入48g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出。你认为“全部溶解”的原因可能是。发布:2024/12/5 8:0:1组卷:35引用:1难度:0.5
相关试卷


