化学老师交给某研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质。该小组的同学进行了如下实验探究:
【提出问题】
猜想Ⅰ:没变质,全部是NaOHNaOH;
猜想Ⅱ:部分变质,既含有NaOH又含有Na2CO3;
猜想Ⅲ:完全变质,全部是Na2CO3。
【查阅资料】
i.已知信息:BaCl2+Na2CO3═2NaCl+BaCO3↓
ⅱ.部分盐溶液在常温下的pH如下:
| 稀溶液 | NaCl | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
请你与他们一起共同完成,并回答所给问题:
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品10.00g溶于50mL水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应,静置 |
有白色沉淀生成 有白色沉淀生成
|
说明久置固体中,一定含有Na2CO3 |
| ②用 玻璃棒 玻璃棒 蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡 标准比色卡 比较,测出pH |
pH=11 | 说明久置固体中,还一定含有 NaOH NaOH (填化学式) |
检验碳酸钠并保证碳酸钠被全部去除,排除对氢氧化钠检验的干扰
检验碳酸钠并保证碳酸钠被全部去除,排除对氢氧化钠检验的干扰
。【实验结论】通过实验,说明上述猜想中
Ⅱ
Ⅱ
(填“猜想Ⅰ”、“猜想Ⅱ”或“猜想Ⅲ”)是正确的。【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为9.85g,则原试剂中NaOH的质量分数为
47%
47%
(假定试剂中无其他杂质,忽略实验损耗)。【反思】久置氢氧化钠变质的原因是
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
(用化学方程式表示)。【提升】能否通过取适量试剂溶于水,然后滴加酚酞的方法作出判断:
不能
不能
(填“能”或“不能”),理由是碳酸钠和氢氧化钠的溶液都显碱性,都能使无色酚酞变红,无法确定组分
碳酸钠和氢氧化钠的溶液都显碱性,都能使无色酚酞变红,无法确定组分
。【答案】NaOH;有白色沉淀生成;玻璃棒;标准比色卡;NaOH;检验碳酸钠并保证碳酸钠被全部去除,排除对氢氧化钠检验的干扰;Ⅱ;47%;2NaOH+CO2=Na2CO3+H2O;不能;碳酸钠和氢氧化钠的溶液都显碱性,都能使无色酚酞变红,无法确定组分
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/20 0:0:1组卷:34引用:1难度:0.5
相似题
-
1.某混合气体X由CO2、CO、H2O(水蒸气)、H2中的两种或两种以上组成,X气体依次通过如图1装置(假定每步反应均完全),现象分别为:A中溶液变浑浊;B中固体变为红色;C中粉末变为蓝色;D中溶液变浑浊。
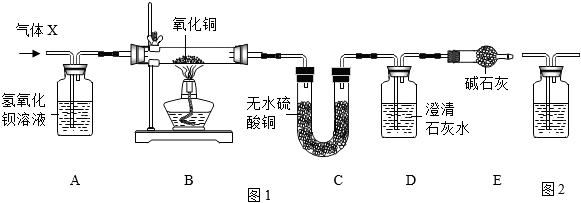
完成下列问题:
(1)该实验能得出CO气体一定存在的证据是;
(2)只要在图1中加装一个图2装置,就能确定原混合气体X中是否含有H2。
①写出图2装置中试剂名称;
②该装置连接在图1中哪两个装置之间(用字母表示)。发布:2024/12/28 16:0:2组卷:208引用:8难度:0.5 -
2.碱式碳酸锌[Znx(OH)y(CO3)Z]是制备ZnO的原料,其化学反应表达式为:Znx(OH)y(CO3)Z
ZnO+CO2↑+H2O(x,y,z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):熔烧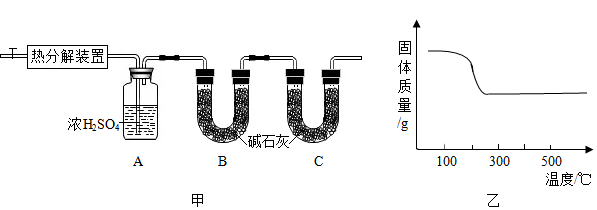
(1)图甲中装置B的作用是。
(2)查阅资料发现,在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到℃(选填“200”“300”或“400“),才能彻底分解碱式碳酸锌。
(3)部分实验步骤为:“⋯⋯加热前先通入N2排尽装置内的空气,关闭通入N2的活塞,⋯⋯控制一定温度下加热⋯⋯”。实验过程中,可根据哪一装置中的什么现象来判断碱式碳酸锌样品已完全分解?发布:2024/12/28 16:30:2组卷:33引用:2难度:0.5 -
3.工业上用电解饱和食盐水的方法制备烧碱,小乐对用此方法生产的、外包装破损的烧碱样品进行了如下探究。
【提出问题】烧碱样品中含有哪些杂质?
【建立猜想】猜想1:可能含有碳酸钠,依据是氢氧化钠能和二氧化碳反应生成碳酸钠。
猜想2:可能含有氯化钠,依据是在化工生产中,原料可能。
【实验探究】
【反思评价】除去烧碱样品中含有的少量碳酸钠,可选用的药品是实验操作 实验现象 实验结论 取少量烧碱样品于试管中,加适量水溶解,加入过量的稀硝酸,再滴加少量硝酸银溶液 烧碱样品中含碳酸钠和氯化钠 。
A.CuCl2溶液
B.Ba(NO3)2溶液
C.Ba(OH)2溶液
D.KOH溶液发布:2024/12/28 16:0:2组卷:22引用:9难度:0.5


