已知实验室常用二氧化锰和浓盐酸制取氯气,某化学实验小组用如图1所示实验装置制取纯净、干燥的氯气。请回答下列问题:
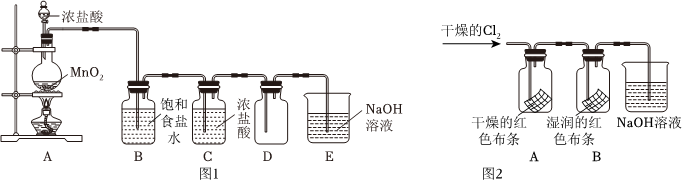
(1)请写出该实验中制取氯气的化学方程式:MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2OMnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O。
(2)装置B的目的是 除去Cl2中混有的HCl除去Cl2中混有的HCl,装置C的作用是 吸收Cl2中混有的水蒸气吸收Cl2中混有的水蒸气。
(3)在制取氯气的反应中,浓盐酸表现的性质有 还原性和酸性还原性和酸性。
(4)为了防止污染空气,在装置E中盛装冷的NaOH溶液,吸收氯气后的溶液具有漂白性。
①从氧化还原的角度分析,装置E中发生反应时Cl2的作用是 既做氧化剂,也做还原剂既做氧化剂,也做还原剂。
②该漂白性溶液的有效成分是 次氯酸钠次氯酸钠(填名称)。
③检验该漂白性溶液中是否含有Cl-的方法是 取少量溶液于试管中,滴加硝酸酸化的硝酸银溶液,若有白色沉淀生成,则含有Cl-取少量溶液于试管中,滴加硝酸酸化的硝酸银溶液,若有白色沉淀生成,则含有Cl-,有关离子方程式为 Ag++Cl-=AgCl↓Ag++Cl-=AgCl↓。
(5)小何设计了如图2所示实验,为进行图2实验,需要一瓶体积为500mL的氯气。(常温下氯气的密度为2.91g/L)
①理论上制取这瓶氯气需要 1.781.78gMnO2(结果保留至0.01)。但在实际称取时,我们往往会称取适当多于理论的量,其主要原因是 MnO2不能完全反应完MnO2不能完全反应完。
②通入干燥的氯气后观察到装置A中干燥的红色布条不褪色,装置B中湿润的红色布条褪色,由此可以得出的结论是 干燥的氯气不具有漂白作用,潮湿的氯气具有漂白作用干燥的氯气不具有漂白作用,潮湿的氯气具有漂白作用。
△
△
【答案】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;除去Cl2中混有的HCl;吸收Cl2中混有的水蒸气;还原性和酸性;既做氧化剂,也做还原剂;次氯酸钠;取少量溶液于试管中,滴加硝酸酸化的硝酸银溶液,若有白色沉淀生成,则含有Cl-;Ag++Cl-=AgCl↓;1.78;MnO2不能完全反应完;干燥的氯气不具有漂白作用,潮湿的氯气具有漂白作用
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/6 2:0:1组卷:41引用:1难度:0.7
相似题
-
1.为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如图.其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸.干燥红色布条、浓硫酸、湿润红色布条.
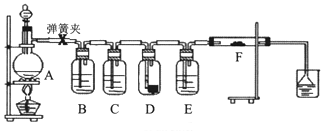
请回答:
(1)E中浓硫酸的作用.
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是.
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有.
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量.发布:2025/1/15 8:0:2组卷:17引用:1难度:0.3 -
2.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
 发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8
发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8 -
3.实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图,下列说法不正确的是( )
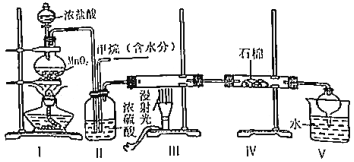 发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7
发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7


