某同学用水果果肉作为催化剂,用如图装置探究影响过氧化氢溶液分解速率的因素。
【查阅资料】
i.过氧化氢分解酶是一种广泛存在于植物中的生物酶,其催化效果受温度影响,超过55℃会失去活性。
ii.植物果肉中含有的某些金属离子也可以催化过氧化氢的分解,且受热后性质不变。
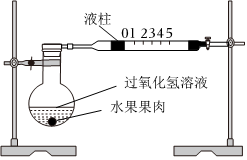
【进行实验】室温下,向烧瓶中加入10 mL不同浓度的过氧化氢溶液,再与3g水果果肉混合,记录液柱从0移动至5的时间。
| 序号 | 过氧化氢溶液 | 催化剂 | 液柱从0移动至5的时间/s | ||
| 浓度/% | 体积/mL | 种类 | 质量/g | ||
| ① | 3 | 10 | 苹果果肉 | 3 | 286 |
| ② | 5 | 10 | 苹果果肉 | 3 | 227 |
| ③ | 10 | 10 | 苹果果肉 | 3 | 176 |
| ④ | 10 | 10 | 香蕉果肉 | 3 | 14 |
| ⑤ | 10 | 10 | 水蜜桃果肉 | 3 | 31 |
(1)进行实验前,用双手捂住烧瓶底部,观察到液柱向右缓缓移动,松手后,液柱又返回原点,说明
装置不漏气
装置不漏气
。(2)由①②③可以得到的结论是
其它条件相同时,过氧化氢溶液浓度越大,反应速率越快
其它条件相同时,过氧化氢溶液浓度越大,反应速率越快
。(3)③④⑤的目的是
比较不同果肉的催化效果
比较不同果肉的催化效果
。(4)①中,若将过氧化氢溶液浓度改为1%,则液柱从0移动至5的时间
>
>
(“>”、“<”或“=”)286s。【继续实验】
(5)补做实验证明了催化剂质量对过氧化氢溶液的分解速率也有影响。
实验方案:室温下,向烧瓶中加入10 mL浓度为5%的过氧化氢溶液,
加入5g苹果果肉,记录液柱从0移动至5的时间
加入5g苹果果肉,记录液柱从0移动至5的时间
。(6)同学们利用如图装置进一步证明了苹果果肉的催化作用主要来自生物酶而不是果肉中的金属离子。将3g苹果果肉置于80℃的烘箱中2h使过氧化氢酶完全失活,取出恢复至室温后,向烧瓶中加入10mL浓度为10%的过氧化氢溶液与烘干后的苹果果肉混合,实验过程中观察到
液柱从0移动至5的时间远大于176s
液柱从0移动至5的时间远大于176s
。【考点】影响化学反应速率的因素探究;催化剂的特点与催化作用.
【答案】装置不漏气;其它条件相同时,过氧化氢溶液浓度越大,反应速率越快;比较不同果肉的催化效果;>;加入5g苹果果肉,记录液柱从0移动至5的时间;液柱从0移动至5的时间远大于176s
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/4 6:0:3组卷:75引用:2难度:0.5
相似题
-
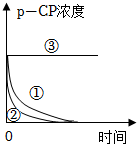 1.Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表)。
1.Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表)。
(1)请结合上述介绍将表中空格补充完整。
(2)实验测得p-CP的浓度随时间变化的关系如图所示,根据实验①、②图像可得出结论:实验编号 实验目的 温度/℃
pH浓度/(mg•L﹣1) H2O2 Fe2+ ① 为②③提供参照 25 3 204 16.8 ② 探究温度对降解反应速率的影响
3 204 16.8 ③ 探究溶液pH对降解反应速率的影响 25 10 204 16.8 。
(3)为测定不同时间内有机物降解的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据本题信息,将样品从反应器中取出后应立即将其放入某药品中,反应会迅速停止,该药品可能是。
A盐酸溶液 B氢氧化钠溶液 C稀硫酸溶液 D碳酸钠溶液发布:2024/11/25 8:0:2组卷:3引用:0难度:0.3 -
2.据图1装置图回答问题
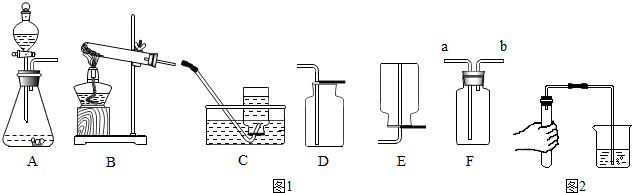
(1)甲同学用氯酸钾和二氧化锰共热制备和收集氧气,他应选用的气体发生装置是(填序号).他用装置C来收集的原因是,当看到导管口的时他才开始收集氧气.
(2)该同学用如图2所示的方法进行气密性检查,如果装置不漏气,可以看到,将手松开一段时间后(导管仍插入水中),可以看到导管中会形成一段水柱.
(3)因为氧气的密度比空气的稍大,所以还可以选用(填序号)来收集氧气,其验满的方法是.
(4)老师提醒可以用F(万能瓶)来收集气体,则甲同学应将发生装置的导管与F的导管(选填a或b)相连接.
(5)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,这位同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想Ⅰ:反应生成的二氧化锰(MnO2)分解放出O2;
猜想Ⅱ:反应生成的锰酸钾(K2MnO4)分解放出O2;
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想(选填Ⅰ或Ⅱ)错误;
第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是.
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?.
(6)丙同学选择用双氧水和二氧化锰混合来制氧气,则他应选用的气体发生装置是(填序号).以下是他探究影响该反应速率因素的相关实验数据.
通过以上实验数据的分析,可知,过氧化氢分解制氧气的化学反应速率与实验
序号H2O2溶液浓度% H2O2溶液体积/mL 温度℃ MnO2用量/g 收集到的
氧气体积/mL反应所需的
时间/s① 5 1 20 1 30.29 ② 5 1 20 0.1 4 16.75 ③ 15 1 20 0.1 4 6.04 ④ 30 1 55 2 10.76 、、等因素有关;发生装置中的(填仪器名称)也可以帮助控制反应的速率.发布:2024/12/18 8:0:1组卷:12引用:2难度:0.5 -
3.下列探究影响化学反应速率因素的实验中,实验方案正确的是( )
选项 影响因素 实验方案 A 接触面积 将1g块状石灰石和20mL10%的稀盐酸、1g粉末状石灰石与20mL10%的稀硫酸混合,比较产生气泡的快慢 B 催化剂的种类 将0.5g二氧化锰、1g氧化铁分别与10mL6%的过氧化氢溶液混合,比较产生气泡的快慢 C 反应物的种类 分别将木炭在空气中、氧气中燃烧,比较反应的剧烈程度 D 反应物的性质 分别用酒精灯加热表面积相同的镁片和铁片,比较在空气中能否被点燃 发布:2024/12/25 13:0:1组卷:114引用:4难度:0.7


