溴单质是重要的化工原料之一,工业上从海水中提取溴的流程如图1:(已知:海水中溴元素主要以Br-形式存在)
 (1)将吹出后的含的空气按一定速率通入吸收塔,用和水进行吸收,写出吸收反应的化学方程式:Br2+SO2+2H2O=H2SO4+2HBrBr2+SO2+2H2O=H2SO4+2HBr。
(1)将吹出后的含的空气按一定速率通入吸收塔,用和水进行吸收,写出吸收反应的化学方程式:Br2+SO2+2H2O=H2SO4+2HBrBr2+SO2+2H2O=H2SO4+2HBr。
(2)吸收后的空气进行循环利用。吹出时,Br2吹出率与吸收塔中SO2流量的关系如图2所示。SO2流量过大,Br2吹出率反而下降的原因是:过量的二氧化硫随“吸收Br2后的空气”进入“吹出”步骤,与溴反应,使溴吹出率下降,反应方程式为:SO2+Br2+2H2O=2HBr+H2SO4过量的二氧化硫随“吸收Br2后的空气”进入“吹出”步骤,与溴反应,使溴吹出率下降,反应方程式为:SO2+Br2+2H2O=2HBr+H2SO4。
(3)“吸收”及后续步骤的工艺也可采用如图3流程。写出上述步骤①中发生反应生成一种气体的离子方程式:3Br2+3CO-3=5Br-+BrO-3+3CO2↑3Br2+3CO-3=5Br-+BrO-3+3CO2↑。当有3molBr2参加反应,发生转移的电子的物质的量为 5mol5mol。
(4)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图4所示,请回答下列问题。
i.反应开始至2min末,以SO2的浓度变化表示该反应的平均速率是 1.25mol⋅L-1⋅min-11.25mol⋅L-1⋅min-1;2min时,反应是否达到化学平衡状态 否否(填“是”或“否”)。
ii.关于该反应下列说法不正确的是 bcbc。
a.催化剂可以加快化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.当生成2molSO2且消耗2molSO3时,反应达到化学平衡状态
(5)我国科学家最新研发出了可充电的非水相镁—溴电池,其工作原理如图5所示(正、负极区之间的离子选择性膜只允许Mg2+通过;反应前,正、负极区电解质溶液质量相等)。下列说法正确的是 ABDABD。
A.Mg作负极,发生氧化反应
B.石墨电极上发生的电极反应为Br-3+2e-═3Br-
C.用该电池对铅蓄电池进行充电时,N端与铅蓄电池中的Pb电极相连
D.当外电路通过0.2mol电子时,正、负极区电解质溶液质量差为2.4g
CO
-
3
B
r
O
-
3
CO
-
3
B
r
O
-
3
B
r
-
3
【答案】Br2+SO2+2H2O=H2SO4+2HBr;过量的二氧化硫随“吸收Br2后的空气”进入“吹出”步骤,与溴反应,使溴吹出率下降,反应方程式为:SO2+Br2+2H2O=2HBr+H2SO4;3Br2+3=5Br-++3CO2↑;5mol;1.25mol⋅L-1⋅min-1;否;bc;ABD
CO
-
3
B
r
O
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/1 8:0:9组卷:20引用:1难度:0.7
相似题
-
1.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
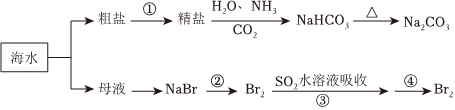 发布:2024/12/30 3:30:1组卷:129引用:9难度:0.6
发布:2024/12/30 3:30:1组卷:129引用:9难度:0.6 -
2.海水是化学元素的宝库,从海水中可以提取或生产多种化工原料,如食盐、氯气、单质溴、镁、纯碱等,它们在工农业生产中有着广泛的用途.根据学过的知识回答下列问题:
(1)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
①其反应原理为:(用离子方程式表示).
②配制250mL 4.0mol•L-1NaOH溶液,需要用到的玻璃仪器,除烧杯、玻璃棒外,还必须用到的是.
(2)工业制得粗硅后,再与氯气等物质发生反应,最终得到纯硅.请写出工业制取粗硅的化学方程式:
(3)金属镁被誉为“国防金属”,若镁起火,不能用CO2来灭火,其原因可用化学方程式表示为
(4)①若Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是,
②若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是.发布:2024/10/27 17:0:2组卷:11引用:1难度:0.5 -
3.海水资源开发利用的部分过程如图所示:
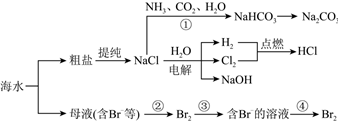
下列说法正确的是( )发布:2024/11/3 6:0:1组卷:50引用:3难度:0.7


