Ⅰ.某研究小组利用如图1所示装置探究金属Fe的腐蚀与防护条件{已知Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀}。反应一段时间后,分别向①区和②区的Cu电极附近滴加酚酞试液,向①区和②区的Fe电极附近滴加K3[Fe(CN)6]溶液。
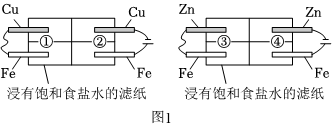
(1)①区在Cu电极附近,②区Fe电极附近可观察到的现象分别是 出现红色出现红色、出现蓝色沉淀出现蓝色沉淀,④区Zn电极的电极反应式为 2H2O+2e-═H2↑+2OH-2H2O+2e-═H2↑+2OH-。
(2)上述①③两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对不活泼的金属被保护,根据此原理采取的金属防护方法称为 牺牲阳极的阴极保护法牺牲阳极的阴极保护法。
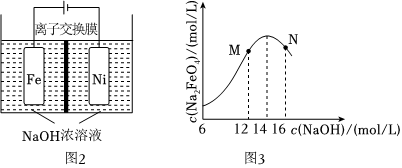
Ⅱ.某研究小组又利用图2装置制取有广泛用途的 Na2FeO4,同时获得氢气:
Fe+2H2O+2OH- 电解 Fe O2-4+3H2↑。装置通电后,铁电极附近生成紫红色Fe O2-4,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
(1)电解过程中须将阴极产生的气体及时排出,其原因是 防止Na2FeO4被H2还原,降低Na2FeO4的产率防止Na2FeO4被H2还原,降低Na2FeO4的产率。
(2)c(Na2FeO4)随初始c(NaOH)的变化如图3所示。M、N两点的c(Na2FeO4)均低于最高值的原因是 M点,c(NaOH)低,Na2FeO4的稳定性较差,反应速率慢,使Na2FeO4的产率降低,N点c(NaOH)高,铁电极有氢氧化铁生成,使Na2FeO4的产率降低M点,c(NaOH)低,Na2FeO4的稳定性较差,反应速率慢,使Na2FeO4的产率降低,N点c(NaOH)高,铁电极有氢氧化铁生成,使Na2FeO4的产率降低。
电解
O
2
-
4
O
2
-
4
【考点】原电池与电解池的综合;金属的腐蚀与防护.
【答案】出现红色;出现蓝色沉淀;2H2O+2e-═H2↑+2OH-;牺牲阳极的阴极保护法;防止Na2FeO4被H2还原,降低Na2FeO4的产率;M点,c(NaOH)低,Na2FeO4的稳定性较差,反应速率慢,使Na2FeO4的产率降低,N点c(NaOH)高,铁电极有氢氧化铁生成,使Na2FeO4的产率降低
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/13 20:0:2组卷:16引用:2难度:0.5