某化学课堂围绕“酸碱盐的性质”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
片段一:
A小组同学发现实验台上摆放的药品中(如图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液可能是:1、氯化钠溶液;2、氢氧化钠溶液;3、碳酸钠溶液。
【资料提示】碳酸钠溶液呈碱性。
【实验推断】(1)小丽取样滴加无色酚酞试液,溶液呈红色,得出结论:该溶液不可能是 氯化钠氯化钠溶液,理由是 氯化钠溶液显中性,不能使酚酞试液变色氯化钠溶液显中性,不能使酚酞试液变色。
(2)小华取来一个装满二氧化碳的软质塑料瓶,将该溶液倒进塑料瓶中一部分,迅速拧紧瓶盖,振荡,结果瓶子变瘪。小华得出结论:该溶液是氢氧化钠溶液。
小明同学认为小华的结论不正确,理由是 二氧化碳能够溶于水,溶于水后能够导致塑料瓶变瘪二氧化碳能够溶于水,溶于水后能够导致塑料瓶变瘪。
如何改进实验来进行判断?用水做对比试验用水做对比试验。
(3)小刚另取样滴加稀盐酸有 气泡气泡产生,小刚得出结论:该溶液是碳酸钠溶液。
小青认为小刚的结论不完全正确,理由是 氢氧化钠变质后生成碳酸钠氢氧化钠变质后生成碳酸钠。
(4)如果要验证是否是碳酸钠溶液,还可以用 氯化钡溶液氯化钡溶液进行验证(填写与(3)类别不同的物质),如果出现 白色沉淀白色沉淀现象,则证明是碳酸钠溶液。
【探究启示】实验取完药品后应 立即盖上瓶塞立即盖上瓶塞。
片段二:
B小组同学将一定量的稀硫酸滴加到盛有NaOH溶液的小烧杯中。实验中未观察到明显现象,部分同学产生了疑问。
【提出问题】反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想。
猜想一:只有Na2SO4
猜想二:有 Na2SO4和H2SO4Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
【实验探究】
(1)小雷同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 NaOHNaOH。
(2)小红同学向反应后溶液滴加氯化钡溶液,产生白色沉淀,证明溶液中有硫酸,他的方案是否正确 不正确不正确,原因是 硫酸钠也与氯化钡反应产生白色沉淀硫酸钠也与氯化钡反应产生白色沉淀。
(3)你能再设计两个方案证明猜想二正确吗?方案是(包括实验过程、现象及结论,其中“实验过程”选择的药品不可以用酸碱指示剂,不可与上述实验方案中药品类别重复,“结论”的表述中能用化学方程式表示的要写出化学方程式)
| 步骤 | 现象 | 结论 |
| 方案一 |
粉末溶解,溶液变蓝色 粉末溶解,溶液变蓝色
|
CuO+H2SO4=CuSO4+H2O CuO+H2SO4=CuSO4+H2O
|
| 方案二 |
粉末溶解,有气泡产生,溶液变浅绿色 粉末溶解,有气泡产生,溶液变浅绿色
|
Fe+H2SO4=FeSO4+H2↑ Fe+H2SO4=FeSO4+H2↑
|
【答案】氯化钠;氯化钠溶液显中性,不能使酚酞试液变色;二氧化碳能够溶于水,溶于水后能够导致塑料瓶变瘪;用水做对比试验;气泡;氢氧化钠变质后生成碳酸钠;氯化钡溶液;白色沉淀;立即盖上瓶塞;Na2SO4和H2SO4;NaOH;不正确;硫酸钠也与氯化钡反应产生白色沉淀;粉末溶解,溶液变蓝色;CuO+H2SO4=CuSO4+H2O;粉末溶解,有气泡产生,溶液变浅绿色;Fe+H2SO4=FeSO4+H2↑
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/23 4:0:1组卷:63引用:1难度:0.5
相似题
-
1.仓库中有一包氮肥的包装标签模糊不清,有同学进行了以下探究:
(1)操作③用玻璃棒搅拌的目的是.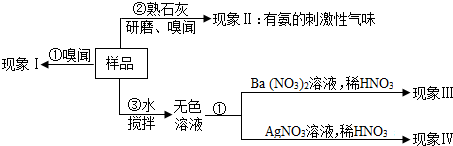
(2)请完成如表(已知AgCl和BaSO4是难溶于水和酸的白色固体):
(3)若现象Ⅲ、Ⅳ都无现象,则该氮肥可能是假设和现象 判断和化学方程式 a 若现象I为无氨味. 则样品中不含 (填名称).b 由操作②现象判断. 该样品一定含有 离子.c 若现象Ⅲ为白色沉淀,现象Ⅳ为无沉淀. 则样品中含有 (写名称),该反应的化学方程式为.d 若现象Ⅲ为“无沉淀”,现象Ⅳ为白色沉淀. 则样品中含有 (写化学式),该反应的化学方程式为.(写化学式);若操作②现象为无气味、现象Ⅲ、Ⅳ无现象,则该氮肥可能是(只写一种).发布:2024/12/24 11:1:11组卷:364引用:5难度:0.1 -
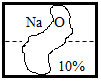 2.某化学兴趣小组的同学在整理化学药品柜时【提出问题】这瓶无色溶液是什么物质的溶液?
2.某化学兴趣小组的同学在整理化学药品柜时【提出问题】这瓶无色溶液是什么物质的溶液?
【查阅资料】①20℃是碳酸钠的溶解度是21.8g,碳酸氢钠的溶解度是9.6g,硫酸钠的溶解度19.5g,硝酸钠的溶解度是88g。
②碳酸钡是不溶于水的白色固体,硫酸钡是既不溶解于水又不溶解于酸的白色固体;
③Ca(OH)2和Ba(OH)2的不同温度下的溶解度如表所示:
【猜想与假设】小组同学提出了如下假设:温度(℃) 10 20 30 40 50 60 Ca(OH)2 0.17g 0.16g 0.15g 0.14g 0.13g 0.12g Ba(OH)2 2.48g 3.89g 5.59g 8.22g 13.12g 20.94g
①碳酸钠溶液;②硫酸钠溶液;③碳酸氢钠溶液;④硝酸钠溶液
【讨论交流】在老师的指导下,小组同学认为假设不合理,理由是。
【进行实验】小组同学设计并进行了如下实验,请你完善小组同学的“相互评价”。
【实验反思】请写出硫酸钠和氢氧化钡反应的化学方程式实验组别 操作、现象与结论 结论与评价 第一组 取少量的样品溶液于一试管中,向其中加入稀盐酸,试管中无明显现象。猜想②成立。 你认为此结论 (填“正确”或不正确”),理由是。第二组 取少量的样品溶液于一试管中,向其中加入氢氧化钡溶液,试管中出现白色沉淀。猜想②成立。 此结论不正确,要想进一步确定猜想②成立,还需进行的实验是 。。
【注意:若答对下列两个小题奖励4分,化学试卷总分不超过60分】
【拓展提升】长期存放的氢氧化钠溶液会变质生成碳酸钠,为探究氢氧化钠变质的程度,实验室常用先加过量的氯化钙溶液或氯化钡溶液充分反应后过滤,再在滤液中滴加酚酞溶液的方案进行实验。
【实验反思】实验发现加氯化钡溶液比加氯化钙溶液实验结果更准确,原因是。如果使用氯化钙溶液,要达到实验目的,你认为改进实验的方法是。发布:2024/12/25 16:30:1组卷:91引用:2难度:0.5 -
3.实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图1),化学小组的同学经过询问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
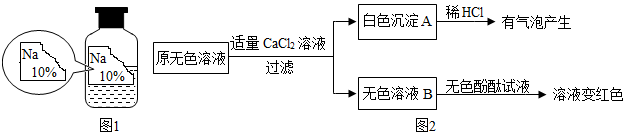
【进行猜想】
猜想I:原溶液的溶质是NaCl;
猜想Ⅱ:原溶液的溶质是NaOH;
猜想Ⅲ:原溶液的溶质是Na2CO3;
猜想 IV:原溶液的溶质是NaHCO3。
【查阅资料】常温下,有关物质的相关信息如表:
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为物质 NaCl NaOH Na2CO3 NaHCO3 常温下的溶解度/g 36 109 21.5 9.6 常温下稀溶液的pH 7 13 11 9 。
【进行实验】
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是。
(2)同学们另取样品又进行了如下实验,实验过程如图2:
①生成白色沉淀A的化学方程式。
②通过实验可以判断样品无色溶液中含有的溶质有
【获得结论】
实验完成后,最终得到的结论:原瓶中的溶质是,且已变质。发布:2024/12/25 16:0:1组卷:142引用:5难度:0.5


