如图是铜与浓硫酸反应并验证其产物性质的装置图.请回答下列问题。
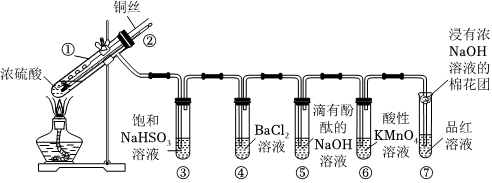
(1)试管①中发生反应的化学方程式为 Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2OCu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O;其中硫酸发生了 还原还原(填“氧化”或“还原”)反应。
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2具有 酸性酸性、还原性还原性、漂白性。
(3)下列说法正确的是 abab(填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是 bcbc(填字母)。
a.HCl
b.Fe2O3
c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为 SO2+Cl2+2H2O+Ba2+=4H++2Cl-+BaSO4↓SO2+Cl2+2H2O+Ba2+=4H++2Cl-+BaSO4↓。
△
△
【考点】浓硫酸的性质实验.
【答案】Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;还原;酸性;还原性;ab;bc;SO2+Cl2+2H2O+Ba2+=4H++2Cl-+BaSO4↓
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/3 8:0:1组卷:27引用:4难度:0.5
相似题
-
1.下列依据实验方案和现象对浓硫酸性质做出的判断合理的是( )
实验方案 实验I: 
实验Ⅱ: 
实验现象 试纸中心区域变黑,边缘变红 黑色固体溶解,溶液接近无色(溶液中锰元素仅以Mn2+存在),产生能使带火星的木条复燃的无色气体 发布:2024/12/30 11:30:1组卷:167引用:8难度:0.5 -
 2.实验室为探究铁与足量浓硫酸的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( )发布:2024/12/30 14:0:1组卷:116引用:3难度:0.7
2.实验室为探究铁与足量浓硫酸的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( )发布:2024/12/30 14:0:1组卷:116引用:3难度:0.7 -
3.某小组同学探究浓硫酸的性质,向试管①、②中加入等量的98%的浓硫酸,实验如下。下列对实验的分析不合理的是( )
实验1 实验2 实验3 装置 


现象 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 溶液变黄;把湿润的品红试纸靠近试管口,试纸褪色 溶液变深紫色(经检验溶液含单质碘) 发布:2024/12/30 7:30:1组卷:192引用:5难度:0.7


