如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.

请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:CH4-8e-+10 OH-═CO32-+7H2OCH4-8e-+10 OH-═CO32-+7H2O.
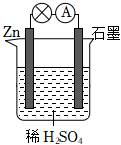
(2)乙池中总反应的离子方程式为2Cl-+2H2O 电解 Cl2↑+H2↑+2OH-2Cl-+2H2O 电解 Cl2↑+H2↑+2OH-.
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体体积为4.484.48 L.
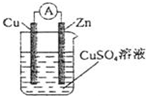
(4)铜丝a处在开始一段时间的现象为溶液变红溶液变红;原因是由于2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红由于2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红(方程式加简要文字说明).
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是bdbd.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)室温下,向浓度均为0.1mol/L的MgSO4和CuSO4混合溶液中逐滴加入氨水,先生成X沉淀,生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
(已知:室温时Ksp[Mg[OH]2]=1.8×10-11mol3•L-3,KSP[Cu(OH)2]=2.2×10-20mol3•L-3).
电解
电解
【考点】原电池与电解池的综合.
【答案】CH4-8e-+10 OH-═CO32-+7H2O;2Cl-+2H2O Cl2↑+H2↑+2OH-;4.48;溶液变红;由于2H++2e-=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红;bd;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+
电解
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 12:0:1组卷:11引用:2难度:0.3