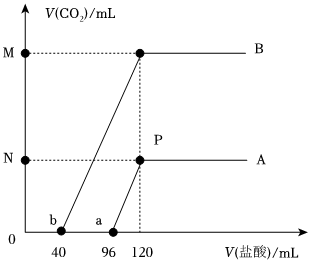
 将80mL一定物质的量浓度的NaOH溶液分成A、B两等份,分别向A、B中通入物质的量不等的CO2,充分反应后,再继续向两溶液中分别逐滴加入xmol•L-1的盐酸,边滴边振荡,产生的CO2气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
将80mL一定物质的量浓度的NaOH溶液分成A、B两等份,分别向A、B中通入物质的量不等的CO2,充分反应后,再继续向两溶液中分别逐滴加入xmol•L-1的盐酸,边滴边振荡,产生的CO2气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
已知:①不考虑水电离出的H+和OH-及CO2-3和HCO-3与水发生的反应;
②不考虑溶液混合时引起的体积和温度的变化;
③只考虑反应过程中盐酸的酸性。
(1)由曲线A可知:相同状况下,M:N=10:310:3,P点溶液中,c(NaCl)=0.75x0.75xmol•L-1(用含x的代数式表示)。
(2)由曲线B可知:向原B等份的NaOH溶液中通入CO2后,所得溶液中的溶质为 Na2CO3和NaHCO3(或NaHCO3和Na2CO3)Na2CO3和NaHCO3(或NaHCO3和Na2CO3)(填化学式),其质量之比为 53:42(或42:53)53:42(或42:53)。
(3)原NaOH溶液中溶质的质量为 9.6x9.6xg。
C
O
2
-
3
HC
O
-
3
【考点】化学方程式的有关计算.
【答案】10:3;0.75x;Na2CO3和NaHCO3(或NaHCO3和Na2CO3);53:42(或42:53);9.6x
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/8 0:0:9组卷:54引用:1难度:0.4
相似题
-
1.钢铁是最重要、用量最大的金属材料之一.完成下列计算:
(1)生产1吨含铁96%的生铁,至少需要氧化铁含量70%的赤铁矿(杂质不含铁)吨.(计算结果保留2位小数)
(2)工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2 FeO+CO→Fe+CO2
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物.通过计算确定此固体可能的成分和它们的物质的量之比.
(3)为了测定某碳素钢(假设只含铁和碳)的含碳量,将10.000g钢样完全溶解于过量的热浓硝酸中,产生了0.300mol气体(假设气体全部逸出,N2O4已折算为NO2).气体用50.00mL 12.00mol/L的NaOH溶液完全吸收后,只生成两种盐,溶液蒸干后得到不含结晶水的固体32.664g.计算:
(1)钢样的含碳量.
(2)参加反应的硝酸的物质的量.发布:2025/1/9 8:0:2组卷:75引用:1难度:0.1 -
2.清洁能源,即绿色能源,它包括核能和“可再生能源”。其中可再生能源包括:水力发电、风力发电、太阳能、生物能(沼气)、地热能、海潮能等这些能源。生物能(沼气)的主要成分是甲烷(CH4),现有甲烷的质量为3.2g,请计算(写出简要计算过程):
(1)该甲烷在标准状况下的体积为多少L?
(2)使该甲烷充分燃烧,需要O2的物质的量是多少?发布:2025/1/25 8:0:2组卷:7引用:1难度:0.7 -
3.乙醇、乙二醇(HOCH2CH2OH)、甘油(丙三醇HOCH2CHOHCH2OH)分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
发布:2024/12/30 19:0:1组卷:87引用:2难度:0.7


