为深度学习酸、碱、盐有关知识,某化学兴趣小组开展了下列探究活动。
(1)探究中和反应。
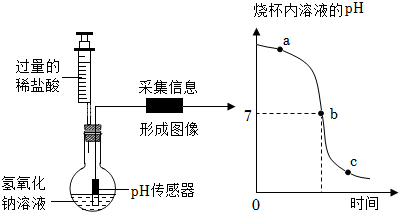
实验开始后将注射器内的液体缓慢地全部注入烧瓶内,用pH传感器测得烧瓶内溶液的pH变化如图所示。
①烧瓶内发生反应的微观实质是 H+ 和 OH- 结合生成 H2OH+ 和 OH- 结合生成 H2O;
②图中c点所示溶液中所含溶质是 NaCl和HClNaCl和HCl(填化学式);
③下列试剂不能验证反应到达c点的是 BCBC(填字母序号)。
A.锌粒
B.硝酸银溶液
C.无色酚酞试液
D.氧化铁
(2)探究碱的性质。
氢氧化钠溶液露置于空气中容易变质,反应的化学方程式为 2NaOH+CO2═Na2CO3+H2O2NaOH+CO2═Na2CO3+H2O;
【查阅资料】
Ⅰ.氯化钙溶液呈中性。
Ⅱ.氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3═CaCO3↓+2NaCl
为探究久置氢氧化钠溶液的变质程度,进行了如下实验:
【实验报告】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,充分反应 | 有 白色沉淀 白色沉淀 生成 |
说明原溶液中一定有Na2CO3 |
| ②取步骤①试管中的少量上层清液,滴加无色酚酞试液 | 溶液变红色 | 说明原溶液中一定有 NaOH NaOH |
该氢氧化钠溶液
部分
部分
(填“部分”或“全部”)变质。【反思与评价】
在上述实验步骤①中,某同学提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案是否可行:
否
否
(填“是”或“否”);用化学方程式解释其原因 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
。【答案】H+ 和 OH- 结合生成 H2O;NaCl和HCl;BC;2NaOH+CO2═Na2CO3+H2O;白色沉淀;NaOH;部分;否;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/25 8:0:9组卷:510引用:6难度:0.2
相似题
-
1.实验室有一瓶配制数天的Na2SO3溶液,现在对其成分进行检测:
【成分猜想】猜想一:只有Na2SO3;
猜想二:;
猜想三:既有Na2SO3,也有Na2SO4。
【查阅资料】①Na2SO3易被空气中的氧气氧化生成Na2SO4.②BaSO4
不溶于稀盐酸和稀硫酸。③Na2SO3和盐酸、硫酸反应均生成SO2。
【方案设计】
【方案分析】方案 实验操作 实验现象 结论 一 
①加入足量的稀盐酸
②再加入足量的BaCl2溶液
猜想三正确 二
①加入足 量的稀硫酸
量的稀硫酸
②再加入足量的BaCl2溶液有气体和白色沉淀生成 猜想一或猜想三正确
(1)方案一中的实验现象为;方案一中加入BaCl2溶液后发生反应的化学方程式为。
(2)方案二的设计是否合理:(填“合理”或“不合理”);若不合理。理由是。
【实验结论】通过分析比较,方案设计(填“—”或“二”)合理。发布:2024/12/24 10:0:46组卷:350引用:3难度:0.5 -
2.氢氧化钠变质的实验探究:
I:向钠离子质量分数均为2%的氯化钠溶液、氢氧化钠溶液、碳酸钠溶液中滴加酚酞,氯化钠溶液不变红,氢氧化钠溶液、碳酸钠溶液变红。
Ⅱ:一位实验员在实验室刚配制一定质量分数的氢氧化钠溶液后,突然接到紧急任务离开,几天后回到实验室才发现没有盖上瓶塞。
(1)你认为能使酚酞变红的微粒为。
A.Na+
B.OH-
C.或由CO2-3引发生成的OH-。CO2-3
(2)氢氧化钠变质为碳酸钠,反应的化学方程式为。溶液中的离子数量如何变化?。(填:不变、减少、增大)
(3)欲证明有氢氧化钠变质为碳酸钠,同学甲认为可选择试剂a:稀盐酸,同学乙认为可选择试剂b;氯化钡溶液,你的观点是。(单项选择题)
A.过量稀盐酸
B.过量氯化钡溶液
C.过量稀盐酸和氯化钡溶液均可以
D.过量稀盐酸和氯化钡溶液均不可以
(4)同学丙认为氢氧化钠只有一部分变质为碳酸钠,溶液中仍然含有氢氧化钠,他通过设计以下实验证明其结论是正确的。
第一步:取少量待测液,向其中加入过量的溶液,过滤;
第二步:向以上滤液中加入,出现的现象,则丙同学观点正确。
(5)100g质量分数为A%的氢氧化钠溶液有部分变质后,同学丁认为仍然可以通过设计实验方案计算出A的数值,其具体的实验方案如下:向变质后的溶液中加入过量的稀盐酸,蒸发结晶,洗涤,干燥,得到5.85g固体,从而可以计算出A的数值。你认为是否可以?(填“可以”或“不可以”)。若不可以,请简述理由,若可以,则写出A的数值。发布:2024/12/25 15:0:2组卷:165引用:3难度:0.5 -
3.小强在实验室里做实验时,拿出一瓶久置的氢氧化钙粉末,进行如下实验:
(1)取氢氧化钙粉末溶于足量水中,有现象出现,小强判断该药品已变质。并写出氢氧化钙变质的反应方程式。
(2)小强进一步做如下实验探究,请你参与并完成表:实验操作步骤 实验现象 实验结论 取样、加适量的水,搅拌,过滤。 ①取少量滤渣于试管中,加入少量的 。粉末变质。 ②取少量滤液于试管中,滴入少量的 溶液。氢氧化钙粉末部分变质。 发布:2024/11/27 8:0:1组卷:108引用:1难度:0.5


