“对比实验”是化学学习中行之有效的思维方法。某化学兴趣小组的同学在学完相关的化学知识后,走进实验室做了如下实验,请你参与并回答下列问题:

(1)如实验一所示,将同样大小的乒乓球碎片和滤纸碎片放在铜片上同时加热,观察到乒乓球碎片先燃烧起来。由此说明乒乓球碎片的着火点比滤纸碎片的着火点 低低(填“高”或“低”)。
(2)如实验二所示,通过对比 ①②①②(从①②③中选填)实验中的现象,可以说明铁生锈需要氧气。
(3)如实验三所示,将等体积的水和氢氧化钠溶液,分别注入两个等容积的装满二氧化碳的同等材质的软塑料瓶中,迅速旋紧瓶盖充分振荡,发现倒入氢氧化钠溶液的软塑料瓶比倒入水的软塑料瓶变得更瘪。由此 可以可以(填“可以”或“不可以”)证明二氧化碳和氢氧化钠发生了反应。
(4)化学兴趣小组为了证明氧化铁也是过氧化氢分解的催化剂,设计以下实验方案。请完成下表并回答:
| 实验 | 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ | 取5mL5%的过氧化氢溶液于试管中,再伸入带火星的木条。 | 木条不复燃。 | 氧化铁是过氧化氢分解的催化剂。 |
| 实验Ⅱ | 取5mL5%的过氧化氢溶液于试管中,加入1g氧化铁,再伸入带火星的木条。 |
产生大量气泡,木条复燃 产生大量气泡,木条复燃
|
(5)小麓同学认为仅凭上述实验Ⅰ和实验Ⅱ还不足以得出结论。兴趣小组同学在以上基础上完善了该实验,最终确认了氧化铁是过氧化氢分解的催化剂。若你是兴趣小组的同学,请你设计完善上述实验方案:
把实验Ⅱ中固体放入足量水中溶解、过滤、洗涤、干燥、称量,质量是1g,说明反应前后氧化铁的质量不变;把得到的1.0g固体加入到5mL5%的过氧化氢溶液中,与实验Ⅰ对比,发现固体仍然能够加快过氧化氢的分解速率,说明反应前后氧化铁的化学性质不变
把实验Ⅱ中固体放入足量水中溶解、过滤、洗涤、干燥、称量,质量是1g,说明反应前后氧化铁的质量不变;把得到的1.0g固体加入到5mL5%的过氧化氢溶液中,与实验Ⅰ对比,发现固体仍然能够加快过氧化氢的分解速率,说明反应前后氧化铁的化学性质不变
。【拓展】
(6)取50g未知浓度的过氧化氢溶液和1g氧化铁混合制取氧气,充分反应后,称量剩余溶液和滤渣的质量为49.4g。通过计算可知过氧化氢溶液中溶质的质量分数为
6.8%
6.8%
。(答案精确到0.1%)【答案】低;①②;可以;产生大量气泡,木条复燃;把实验Ⅱ中固体放入足量水中溶解、过滤、洗涤、干燥、称量,质量是1g,说明反应前后氧化铁的质量不变;把得到的1.0g固体加入到5mL5%的过氧化氢溶液中,与实验Ⅰ对比,发现固体仍然能够加快过氧化氢的分解速率,说明反应前后氧化铁的化学性质不变;6.8%
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/18 8:0:10组卷:52引用:2难度:0.5
相似题
-
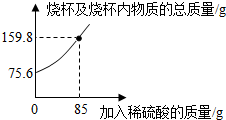 1.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为52.2g的烧杯中,然后缓慢加入一定质量的稀硫酸,当加稀硫酸质量为85g时,反应恰好完全(杂质不反应且产生的气体全部逸出),反应过程中的质量关系如图.完成下列问题:
1.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为52.2g的烧杯中,然后缓慢加入一定质量的稀硫酸,当加稀硫酸质量为85g时,反应恰好完全(杂质不反应且产生的气体全部逸出),反应过程中的质量关系如图.完成下列问题:
(1)该实验取用的样品质量为g.
(2)计算样品中铁的质量分数(写出解题过程).发布:2025/1/9 8:0:2组卷:139引用:39难度:0.1 -
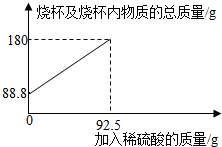 2.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入92.5g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图。
2.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入92.5g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图。
(1)该实验取用的样品质量为g。
(2)反应后所得溶液中的溶质的质量分数。(写出计算过程,结果保留一位小数)
(3)反应结束后,小明不慎向烧杯中多加了10g稀硫酸,若在图中补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的(填:上方、下方或线上)。发布:2025/1/9 8:0:2组卷:4引用:1难度:0.3 -
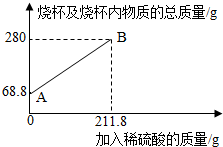 3.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入211.8g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图。
3.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入211.8g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图。
(1)该实验取用的样品质量为g。
(2)求样品中铁的质量分数;反应后所得溶液中的溶质的质量分数。(写出计算过程,结果保留一位小数)
(3)反应结束后,小明不慎向烧杯中多加了20g稀硫酸,若在图中补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的(填:上方、下方或线上)。发布:2025/1/9 8:0:2组卷:8引用:1难度:0.3


