当前位置:
试题详情
A、B、C、D、E为前四周期元素,原子序数依次增大,A为短周期中离子半径最小的金属元素,B为短周期中金属性最强的元素,C元素的单质是一种淡黄色固体,D元素的基态原子在前四周期中未成对电子数最多。E位于元素周期表中第八列。
回答下列问题:
(1)B在焰色反应中发出黄光是一种 AA(填字母)。
A.发射光谱
B.吸收光谱
(2)D元素在元素周期表中的位置为 第四周期第VIB族第四周期第VIB族,在同周期中,与D元素基态原子具有相同最外层电子数的元素为 K、CuK、Cu(填元素符号)。
(3)在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则。请写出A元素与B元素最高价氧化物的水化物反应的离子方程式 Be(OH)2+2OH-=BeO2-2+2H2OBe(OH)2+2OH-=BeO2-2+2H2O,已知A元素与Cl元素的电负性分别为1.5和3.0,则它们所形成的化合物为 共价化合物共价化合物(填“离子化合物”或“共价化合物”)。
(4)某同学画出C元素基态原子的价层电子轨道表示式为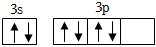 ,该同学所画的轨道表示式违背了 洪特规则洪特规则。C原子能量最高的电子其电子云形状是 哑铃形哑铃形。
,该同学所画的轨道表示式违背了 洪特规则洪特规则。C原子能量最高的电子其电子云形状是 哑铃形哑铃形。
(5)写出E元素基态原子的电子排布式 1s22s22p63s23p63d64s21s22s22p63s23p63d64s2,其两种简单离子中,更加稳定的是 Fe3+Fe3+(填离子符号),理由是 因为Fe2+价电子为3d6,失去1个电子形成更稳定的3d5半充满状态的Fe3+因为Fe2+价电子为3d6,失去1个电子形成更稳定的3d5半充满状态的Fe3+。
B
e
(
OH
)
2
+
2
O
H
-
=
B
e
O
2
-
2
+
2
H
2
O
B
e
(
OH
)
2
+
2
O
H
-
=
B
e
O
2
-
2
+
2
H
2
O
【考点】位置结构性质的相互关系应用.
【答案】A;第四周期第VIB族;K、Cu;;共价化合物;洪特规则;哑铃形;1s22s22p63s23p63d64s2;Fe3+;因为Fe2+价电子为3d6,失去1个电子形成更稳定的3d5半充满状态的Fe3+
B
e
(
OH
)
2
+
2
O
H
-
=
B
e
O
2
-
2
+
2
H
2
O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/31 8:0:9组卷:25引用:2难度:0.7
相似题
-
1.X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。X是宇宙中含量最高的元素,YX3分子呈三角锥形,Z的价电子排布式为nsnnpn+2,五种元素中M的电负性最小,N的最高价含氧酸酸性最强。下列说法正确的是( )
发布:2025/1/5 8:0:1组卷:47引用:1难度:0.5 -
2.已知A、B、C、D、E、F、G都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,D与F同主族,G的原子半径是本周期元素中最小的.则:
(1)A元素为C元素为E元素为
(2)由上述元素形成的10电子分子有、.
(3)由B和D以质量比为3:8组成的化合物与E的同周期相邻主族元素的单质反应的化学方程式为.
(4)G单质与E的最高价氧化物的水化物反应的离子方程式为
(5)B、C、D形成的气态氢化物中,较稳定的是
(6)由A、C、G形成的离子化合物的化学式是.发布:2024/12/30 18:30:1组卷:7引用:3难度:0.5 -
3.A、B、C、D、E为原子序数依次增大的五种短周期元素;A是宇宙中最丰富的元素且与E同主族;B位于元素周期表ⅣA族;C在元素周期表中与B、D相邻;D基态原子的s轨道与p轨道的电子总数相等且p轨道有2个未成对的电子;E是短周期中原子半径最大的元素;F原子核外电子数为29.回答下列问题:
(1)F基态原子的核外电子排布式为。
(2)A、B、C、D、E五种元素中,电负性最小的元素为(填元素符号,下同),第一电离能最大的元素为;A3D+的立体构型为。
(3)A、B可形成多种化合物,其中相对分子质量为28的分子,其中心原子的杂化方式为,该分子中σ键和π键的数目之比为。
(4)化合物BD2和E2D2的晶体类型分别为、。
(5)F单质为面心立方晶体,若F的相对原子质量为M,阿伏加德罗常数为NA,晶胞边长为a cm,则晶体F的密度ρ=g•cm-3。发布:2025/1/18 8:0:1组卷:27引用:2难度:0.3


